
����Ŀ���ȼ��仯�����й㷺��;������������һ�����͵���������
��NaClO2��Cl�Ļ��ϼ�Ϊ____________��
��ʵ�������������Ũ���ᷴӦ�Ʊ�ClO2�������ClO2�⣬����Cl2��KCl�ȣ�д���÷�Ӧ�Ļ�ѧ����ʽ __________��������11.2L��������״������ת�Ƶ�����Ϊ _________��
��ClO2��Cl2������ʱ����������ԭΪCl�������³�ѹ�£��������ClO2������������Cl2��_________����
������ˮ����ClO2�������ˮ�У�Ҫ��ClO2��Ũ����0.1��0.8 mgL��1֮�䡣���������Լ��ˮ��ClO2��Ũ�ȣ���ͬpH����������������ͼ��ʾ�����������£�
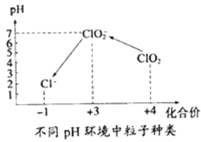
��.ȡһ�������ˮ��������һ�����ĵ⻯�أ��ٽ���Ӧ����Һ�������ԣ������������Һ����Һ������
��.����һ������Na2S2O3��Һ������֪��2S2O32��+I2�TS4O62��+2I����
��.���������ˮ��pH��1��3��
���ʴ�
��ˮ�������Ϊ1.0L���ڲ���IIʱ������1.0��10��3molL��1��Na2S2O3��Һ10mL����ˮ����ClO2��Ũ����_____ mgL��1��
���𰸡�+3 2KClO3+4HCl=2KCl+2ClO2��+Cl2��+2H2O NA��6.02��1023 2.5 0.675
��������
���ɻ��ϼ۴�����Ϊ0�ж�Cl�Ļ��ϼۣ�
��ʵ�������������Ũ���ᷴӦ�Ʊ�ClO2�������ClO2�⣬����Cl2��KCl�ȣ����ݻ��ϼ�����������ȡ�ԭ���غ����д��Ӧ�Ļ�ѧ����ʽ����ϻ��ϼ۵ı仯����ת�Ƶ��ӵ���Ŀ��
�۸��ݵ���ת����Ŀ�����жϣ�
�ܲ���I������Һ�����ԣ���������ClO2������ĵ⻯������ΪI2����������ԭ��ClO2-�����ݻ��ϼ�����������ȡ�ԭ���غ�͵���غ�����ƽ��Ӧ����ʽ������II����һ���� Na2S2O3��Һ��������Ӧ2S2O32-+I2�TS4O62-+2I-��ʹI2��ԭΪI-���Ӷ��ɵù�ϵS2O32-��I-��ClO2���ȼ����ClO2�����ʵ�����Ȼ���ټ����Ũ�ȡ�
��NaClO2��NaΪ+1�ۡ�OΪ2�ۣ��ɻ��ϼ۴�����Ϊ0��֪ClΪ+3�ۣ��ʴ�Ϊ��+3��
��ʵ�������������Ũ���ᷴӦ�Ʊ�ClO2�������ClO2�⣬����Cl2��KCl�ȣ���֪��Ӧ�ķ���ʽΪ2KClO3+4HCl=2KCl+2ClO2��+Cl2��+2H2O���ɷ���ʽ��֪����11.2L��������0.5mol��Ӧ����1molKClO3����Ӧ��KClO3��ClԪ�ػ��ϼ���+5�۽��͵�+4�ۣ�HCl��ClԪ�ػ��ϼ���-1�����ߵ�0�ۣ�������0.5mol����ת��1mol���ӣ���ĿΪNA��6.02��1023���ʴ�Ϊ��2KClO3+4HCl=2KCl+2ClO2��+Cl2��+2H2O��NA��6.02��1023��
��C1O2��Cl2������ʱ����������ԭΪCl��ÿ1molC1O2����ԭΪCl��Ҫ��5mol���ӣ�ÿ1molC12����ԭΪCl��Ҫ��2mol���ӣ����ݵ���ת����Ŀ��ȿ�֪�������C1O2����������Cl2��2.5�����ʴ�Ϊ��2.5��
�ܲ���I������Һ�����ԣ���������ClO2������ĵ⻯������ΪI2����������ԭ��ClO2-��������Ӧ��2ClO2+2I-=2ClO2-+I2������II����һ����Na2S2O3��Һ��������Ӧ2S2O32-+I2�TS4O62-+2I-��ʹI2��ԭΪI-����ɫ����ʧ���ɵù�ϵʽ��2S2O32~I2~2ClO2��n(ClO2)=n(S2O32-)=1.0��105mol��m(ClO2)=n(ClO2)��M(ClO2)=1.0��105mol��67.5gmol1=6.75��10-4g=0.675mg������ˮ��Ϊ1L������ClO2��Ũ��Ϊ��![]() ���ʴ�Ϊ��0.675��
���ʴ�Ϊ��0.675��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����ָ������������½���ѧ��ת��Ϊ���ܵ�װ�á�ij�о�С�����������ȼ�ϵ�ؽ���ˮ�е��Ҷ���![]() �����ɻ����Ѻõ����ʣ������ø�װ��ģ�ҵ��ⷨ��������
�����ɻ����Ѻõ����ʣ������ø�װ��ģ�ҵ��ⷨ��������![]() ��ˮ����������Һ�з�����ӦΪ
��ˮ����������Һ�з�����ӦΪ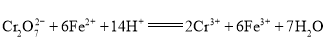 ������ع���ʱ������˵���������( )
������ع���ʱ������˵���������( )
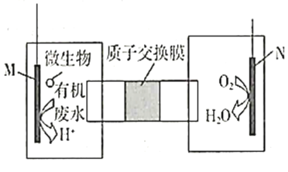
A.Fe��Ӧ��N������
B.![]() �����ӽ���Ĥ���������ƶ�
�����ӽ���Ĥ���������ƶ�
C.����Һ�м�����![]()
![]() �����·������ת��
�����·������ת��![]() ����
����
D.M���缫��ӦʽΪH2N(CH2)2NH2+4H2O-16e-=2CO2��+N2��+16H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȱ������������ֱ��������Ե���(����)
A.2H2SO4(Ũ)��Cu![]() CuSO4��2H2O��SO2��
CuSO4��2H2O��SO2��
B.2H2SO4(Ũ)��C![]() CO2����2H2O��2SO2��
CO2����2H2O��2SO2��
C.H2SO4(Ũ)��NaNO3![]() NaHSO4��HNO3��
NaHSO4��HNO3��
D.H2SO4��Na2SO3===Na2SO4��H2O��SO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���� (�� ��)
A. �п��Ľ���Na��¶�ڿ����У����������䰵2Na��O2=Na2O2
B. һ�������£�2.3 g��Na��ȫ��O2��Ӧ����3.6 g���ʧȥ�ĵ�����Ϊ0.2 NA
C. ����ˮ��Ӧ��2Na��2H2O=2Na����2OH����H2��
D. �������Ż�ʱʹ����ĭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 mL NH4HCO3��Na2CO3�Ļ����Һ�ֳ���ȷݣ�ȡһ�ݼ��뺬a mol�������Ƶ���Һǡ�÷�Ӧ��ȫ����ȡһ�ݼ��뺬b mol HCl������ǡ�÷�Ӧ��ȫ����û����Һ��c(Na��)Ϊ( )
A.( ![]() ��
��![]() ) mol/LB.(2b��a) mol/L
) mol/LB.(2b��a) mol/L
C.(5b��![]() ) mol/LD.(10b��5a) mol/L
) mol/LD.(10b��5a) mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A.��NaOH��Һ��ͨ�����CO2��OH-+CO2=HCO![]()
B.��Na2SiO3��Һ�еμ�ϡ���Na2SiO3+2H+=H2SiO3��+2Na+
C.���MgCl2��Һ��2H2O+2Cl-![]() 2OH-+H2��+Cl2��
2OH-+H2��+Cl2��
D.SO2ˮ��Һ����Br2������SO2+H2O+Br2=SO![]() +2H++2Br-
+2H++2Br-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ��ˮ�Ƹߴ����ʾ��ͼ��ͨ�����ƿ�������K1��K2���ɽ���õ�H2��O2������˵����ȷ����
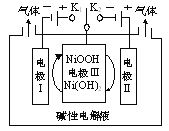
A.��H2ʱ������K2
B.����K1ʱ���缫���������Լ���
C.��O2ʱ���缫��ķ�ӦΪ��NiOOH��e��H2O��Ni(OH)2��OH��
D.ͨ�����ƿ�������K1��K2����ʹ�缫��ѭ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�úͲ������ش��й����⡣
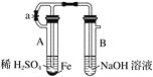
��ͼ����ʾװ�ã������ֲ�ͬ�IJ����ֱ����ʵ�飬�۲�B�����е�����
(1)�ȼн�ֹˮ��a����ʹA�����п�ʼ��Ӧ����ʵ����B�����й۲쵽��������_________________��
��B�����з�����Ӧ�����ӷ���ʽ��____________________________________��
(2)��ֹˮ��a��ʹA������ʼ��Ӧһ��ʱ����ټн�ֹˮ��a����ʵ���й۲쵽��������__________����B�����з�����Ӧ�����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2������ɫ������ˮ������)��һ�ְ�ȫ�ȶ�����Ч�Ͷ�������������ҵ��ͨ�����Ե缫����Ȼ�狀�����ķ����Ʊ�����ԭ����ͼ��ʾ:

����˵������ȷ����
A. b�缫�ӵ�Դ�ĸ�������b����������Y��Һ��ϡ����
B. �������ȷ��������ų���X��Һ��������ҪΪNaCl��NaOH
C. �������ж������ȷ������в���2.24L(��״��)NH3����b������0.6gH2
D. ����a���ĵ缫��ӦʽΪNH4+-6e-+4OH-+3Cl-=NCl3+4H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com