
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.( ![]() -
-![]() ) mol/LB.(2b-a) mol/L
) mol/LB.(2b-a) mol/L
C.(5b-![]() ) mol/LD.(10b-5a) mol/L
) mol/LD.(10b-5a) mol/L
【答案】D
【解析】
500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,每份100 mL,设100 mL溶液中含有NH4HCO3 x mol,Na2CO3 y mol,NH4HCO3和Na2CO3的混合溶液加入NaOH,反应为NH4HCO3+2NaOH=NH3H2O+Na2CO3+H2O,则100 mL溶液中含NH4HCO3为0.5a mol,100 mL溶液中加入含b mol HCl的盐酸的反应为NH4HCO3+HCl=NH4Cl+CO2↑+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑,则其中Na2CO3的物质的量n(Na2CO3)=![]() ×(b-0.5a) mol,根据Na元素守恒可知溶液中含有Na+的物质的量n(Na+)=2n(Na2CO3)=(b-0.5a) mol,由于溶液的体积是100 mL,所以离子浓度c(Na+)=(b-0.5a) mol÷0.1 L=(10b-5a) mol/L;
×(b-0.5a) mol,根据Na元素守恒可知溶液中含有Na+的物质的量n(Na+)=2n(Na2CO3)=(b-0.5a) mol,由于溶液的体积是100 mL,所以离子浓度c(Na+)=(b-0.5a) mol÷0.1 L=(10b-5a) mol/L;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
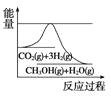
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究FeSO4溶液和AgNO3溶液的反应,设计如下对比实验。
实验 |
Ⅰ |
Ⅱ |
现象 | 连通电路后,电流表指针向右偏转,分别取反应前和反应一段时间后甲烧杯中的溶液,滴加KSCN溶液,前者几乎无色,后者显红色 | 连通电路后,电流表指针向左发生微小的偏转,丙、丁烧杯中均无明显现象 |
下列说法正确的是
A.仅由Ⅰ中的现象可推知Ag+的氧化性强于Fe3+
B.Ⅱ中电流表指针向左偏转的原因是Fe2+氧化了银电极
C.Ⅱ中若将银电极换成石墨电极,电流表指针可能不再向左偏转
D.对比Ⅰ、Ⅱ可知,Ⅰ中NO3-氧化了Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
①加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体。
②氯气的密度比空气大,常用向上排空气法收集氯气。
③闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔。
④在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色。
⑤氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态。
⑥氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程,请回答下列问题。
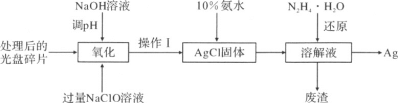
(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为 _____。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为______。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是_______。
(3)操作Ⅰ的名称为_______。化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1:2反应可生成Cl-和一种阳离子__________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是_______。
(4)常温时N2H4·H2O(水合肼)在碱性条件下能还原(3)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到 ______g的单质Ag。
(5)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为 _____,负极的产物有____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物有广泛用途。二氧化氯是一种新型的消毒剂。
①NaClO2中Cl的化合价为____________。
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式 __________。若生成11.2L氯气(标准状况),转移电子数为 _________。
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的_________倍。
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mgL-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
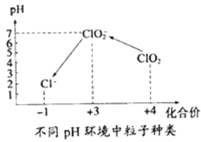
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(己知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3molL-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是_____ mgL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 请回答下列问题:

(1)写出①、②反应的离子方程式
①__________________________________________;
②________________________________________________________
(2)在点燃H2之前必须先进行_______________________________________。
(3)实验小组在点燃用上述装置制得的H2时,①实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因___________________________________________________________________
(4)实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。在改进后的实验中H2的生成速率会_______________。改进后的实验现象为_________________________________________________________________________。
(5)2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是____________,所得溶液的物质的量浓度是______________________。(不计溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡。合金中铁和银的质量比为( )
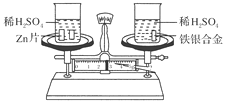
A.65 ∶56B.56 ∶108
C.56 ∶9D.65 ∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活等方面密切相关,下列说法错误的是( )
A.硅胶因为有多孔的结构所以可以作为催化剂载体,催化剂可以提高活化分子百分数,从而加快化学反应速率
B.已知储氢原理CuNi5(s)+2H2(g)![]() CuNi5H4(s) △H,该反应在一定条件下可以自发进行,则有利于储氢的条件是高温低压
CuNi5H4(s) △H,该反应在一定条件下可以自发进行,则有利于储氢的条件是高温低压
C.碳酸饮料打开瓶盖有大量气泡产生的原因是压强减小导致CO2在水中的溶解度减小
D.某些工业生产中的热交换器可以提高能量利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com