
(13��)ƽ�������ʾ�����������в��������ķϲ�����ĩ����SiO2��Fe2O3��CeO2��FeO�����ʣ���ij�����Դ˷�ĩΪԭ�ϣ�������¹������̶���Դ���л��գ��õ�Ce(OH)4��������泥�

��֪��
�������������£�����ˮ��Һ����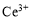 ��
��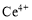 ������Ҫ������ʽ��
������Ҫ������ʽ��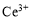 ��ˮ�⣬
��ˮ�⣬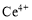 �н�ǿ�����ԡ�
�н�ǿ�����ԡ�
����CeO2������ϡ����
����������泥�aFe2(SO4) 3��b(NH4) 2SO4��cH2O�ݹ㷺����ˮ�ľ���������
��1����������������� ���� ���������������Һ�к���NH4+�ķ����ǣ� ����
��2������Ӧ��֮ǰ��Ҫϴ������B����Ŀ����Ϊ�˳�ȥ�����������������������������ӷ��ţ���
��3����д����Ӧ�ٵĻ�ѧ����ʽ ������������������������������������������������
��4�����õζ����ⶨ�Ƶõ�Ce(OH)4��Ʒ���ȡ�

�ζ�ʱ���ö��������Ķ�����ȷΪ ����������FeSO4��Һ�ڿ�����¶��һ��ʱ����ٽ����еζ������ø�Ce(OH)4��Ʒ���������� ���������ƫ����ƫС������Ӱ�족��
��5������ȡ14.00g���������Ʒ����������ˮ���Ƴ�100mL��Һ���ֳ����ȷݣ�������һ�ݼ�������NaOH��Һ������ϴ�ӳ�����������������صõ�1.60g���壻����һ����Һ�м���0.5mol/L Ba(NO3)2��Һ100mL��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ ����������
��1����ȴ�ᾧ��ȡ������Һ���Թ��У�����NaOH��Һ�����ȣ����Թܿ���һʪ��ĺ�ɫʯ����ֽ������ֽ��������֤������NH4+����2��Fe3+��Fe2+����3��2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2��+4H2O
��4��0.01mol��ƫ��5��Fe2(SO4)3��2(NH4)2SO4��2H2O
��������
�����������1������ʾ��ͼ��֪����������ȴ�ᾧ��Ȼ����ˡ�ϴ�ӡ�����õ�������李��������������Һ�к���NH4+�ķ�����ȡ������Һ���Թ��У�����NaOH��Һ�����ȣ����Թܿ���һʪ��ĺ�ɫʯ����ֽ������ֽ��������֤������NH4+����ȡ������Һ���Թ��У�����NaOH��Һ�����ȣ����Թܿ���һպ��Ũ����IJ����������а��̲�������֤������NH4+����2������Ӧ��֮ǰ��Ҫϴ������B����Ŀ����Ϊ�˳�ȥ�������������Fe3+��Fe2+����3������Ce4+�н�ǿ�����Է�Ӧ����H2O2�л�ԭ�ԣ������������·�Ӧ����ˢٵĻ�ѧ����ʽ2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2��+4H2O���õ�����Ce3+����Һ����4���ζ�ʱ���ö��������ζ��ܵĶ�����ȷΪ0.01ml; ������FeSO4��Һ�ڿ�����¶��һ��ʱ����ٽ����еζ��������ĵ�FeSO4��Һ���ƫ�ⶨ�ĸ�Ce(OH)4��Ʒ������������ƫ�ߣ���5����һ�ݼ���NaOH�����õ��Ĺ���Fe(OH)2, ������������صõ�1.60g������Fe2O3��n(Fe2O3)=1.6g ��160 g/mol =0.01mol.n(Fe)=0.02mol;�ڶ����м���0.5mol/L Ba(NO3)2��Һ100mL��ǡ����ȫ��Ӧ�������BaSO4������n(SO42-)=0.1L��0.5mol/L=0.05mol�����ݵ���غ�ɵ�n(NH4+)��1+0.02mol��3=0.05mol��2�����n(NH4+)=0.04mol.n(H2O)= (7.00g��0.04mol��17g/mol��0.02mol��56g/mol��0.05mol�� 96g/mol)�� 18 g/mol =0.02mol.���Ըþ�����n(Fe3+): n(NH4+): n(SO42-): n(H2O)=0.02:0.04:0.05:0,02=2:4: 5:2.��˸þ���Ļ�ѧʽΪFe2(SO4)3��2(NH4)2SO4��2H2O��
���㣺��������ķ��뷽����NH4+�ļ��顢ʵ�������Ŀ�ġ���ѧ����ʽ����д���ζ�����������ɲⶨ�е�Ӧ�õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����ʮУ��һ��ѧ�����н�ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ij��B��Ԫ��ԭ������Ϊx����ôԭ������Ϊx+1��Ԫ��λ��
A����A�� B����B�� C����B�� D����A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʦ���еڶ�ѧ�����п��Ը�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����У����ۼ����ƻ�����
A.������B.��������ľ̿����C.��������ˮD.�Ȼ�����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ʯ���^�߶���ѧ����ͳ���Ծ��������棩 ���ͣ�ѡ����
0.02mol��L��1��HCN��Һ��0.02mol��L��1��NaCN��Һ�������ϣ���֪�����Һ��C(CN��)<C(Na��)�������й�ϵ�У���ȷ���ǣ� ��
A��C(Na��)>C(CN��)>C( H��)>C(OH�D) B��C(HCN)+C (CN��)=0.04mol��L��1
C��C(Na��)+C(H��)= C(CN��)+C(OH�D) D��C(CN��)>C(HCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ʯ���^�߶���ѧ����ͳ���Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A�������Է����еķ�Ӧ�������ȷ�Ӧ
B����ѧ������ʱ���յ��������ڻ�ѧ���γ�ʱ�ų��������ķ�Ӧ���ڷ��ȷ�Ӧ
C�����߷�Ӧ���¶ȣ�����Ӱٷ������ӣ����Ӽ���Ч��ײ�ļ�����ߣ���Ӧ��������
D������ͨ���ı䷴Ӧ·����ʹ��Ӧ�����������ı䷴Ӧ����Ļ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����5��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ұ������ϵ�һ����ԭ�ӱ���C3H7Clȡ�����γɵ�ͬ���칹���У������������칹��
A��9�� B��1 2�� C��15�� D��20��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��һ��ѧ������������ѧ�Ծ��������棩 ���ͣ������
(10��)ijͬѧ�������ͼ��ʾ��װ�ã��г�װ������ȥ����̽��Ӱ�컯ѧ��Ӧ���ʵ����ء�
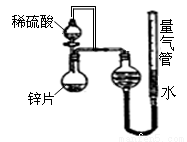
��1��Բ����ƿ�з�����Ӧ�����ӷ���ʽ��
__________________________________________
��2��������װ�ý���ʵ�飬������15.0mL����Ϊ��ʱ�յ㣬
���Ϊt1��t2
��� | ��(H2SO4)/mL | C(H2SO4)/mol��L-1 | t/s |
�� | 10 | 1 | t1 |
�� | 10 | 3 | t2 |
�Ƚ�ʵ����ʵ�����Եó��Ľ�����__________________________________________
��3��ʵ��������ƿ�е����ϡ����������������������ȷ�����Բⶨ���������Ӱ��_____ __________ (�ƫ����ƫС��������Ӱ�족)
��4����пƬ���ɺ����ʵĴ�пƬ���ҿ�����������ʹ��������ʵ����ȫһ�£�����õķ�Ӧ���ʾ���������ʵ���Ӧ�����ݡ���пƬ�����������ʿ����ǣ�����ţ�________
a.ʯī b.�� c.ͭ d.ɳ�����������裩
��5��Ҫ�ӿ�÷�Ӧ�ķ�Ӧ���ʣ������Բ�ȡ�Ĵ�ʩ��________________________������һ�ּ��ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��һ��ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ����ʹ����ȷ����
A���Ľṹʾ��ͼ B��������Ϊ20����ԭ�ӣ�37 17Cl
B��������Ϊ20����ԭ�ӣ�37 17Cl
C�������Ļ�ѧʽ�� KAlSO4��12H2O D��CO2�ĵ���ʽ��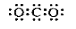
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�˲��и���5��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
(14��)�����ѣ�Ti��������Խ������Ϊ��������֮��ġ���������������ҵ������������Ҫ�ɷ�FeTiO3����FeO��Al2O3��SiO2�����ʣ�Ϊ��Ҫԭ��ұ�������ѣ��������Ĺ�������ͼ���£�
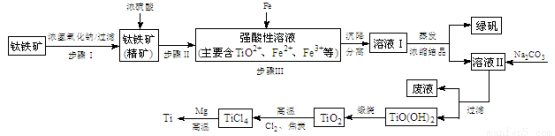
��֪��2H2SO4(Ũ)+ FeTiO3��TiOSO4 + FeSO4 + 2H2O
��1������I�з�����Ӧ�����ӷ���ʽ�� �� ��
��2����֪��TiO2����ˮ�⣬ֻ�ܴ�����ǿ������Һ�С�
25 ��ʱ�����ܵ�����ܽ����pH��ϵ��ͼ��

TiO(OH)2�ܶȻ�Ksp��1��10��29
�ٲ���������мԭ�� �� �� ��
�� TiO2��ˮ������ӷ���ʽΪ ��
����ҺII�м���Na2CO3��ĩ�������� ��
����ҺpH= ʱ��TiO(OH)2�ѳ�����ȫ��
��3��TiCl4��Ti��Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
| TiCl4 | Mg | MgCl2 | Ti |
�۵�/�� | ��25.0 | 648.8 | 714 | 1667 |
�е�/�� | 136.4 | 1090 | 1412 | 3287 |
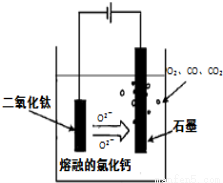
��4�����TiO2�Ʊ��ѵķ�����ͼ��ʾ���÷������ھ߱��������̼������ɱ��͡���Ʒ�����ߡ������Ѻõ�����ŵ������עĿ����֪TiO2����״̬�²��������룬���ʱ������ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com