
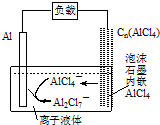
| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
分析 放电时铝为负极,被氧化生成Al2Cl7-,负极反应:方程式为Al+7AlCl4--3e-═4Al2Cl7-,其逆过程就是充电时的阴极反应4Al2Cl7-+3e-=Al+7AlCl4-;正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,其逆过程就是充电时的阳极反应:Cn+AlCl4--e-═Cn[AlCl4],以此解答该题.
解答 解:A.放电时,铝是活泼的金属铝是负极,铝发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故A错误;
B.放电时,正极上AlCl4-进入溶液,负极上Al失电子,则电路中每流过3mol电子,负极减少27g,故B错误;
C.充电时正极与外接电源的正极相连,则泡沫石墨极与外电源的正极相连,故C错误;
D.充电时,Al2Cl7在阴极得电子发生氧化反应,即阴极发生:4Al2Cl7-+3e-=Al+7AlCl4-,故D正确;
故选D.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,为高频考点,侧重学生的分析能力的考查,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
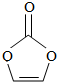
| A. | 分子式为C3H2O3 | B. | 分子中只含有极性键 | ||
| C. | 分子中含6个σ键 | D. | 各碳原子杂化的方式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 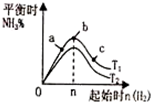 表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1,K2、則:T1<T2,K1>K2 | |
| B. | 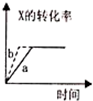 反应:X(g)+2Y(g)?3Z(g),b的溫度比a可能高 | |
| C. | 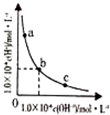 该温度下,加人FeCl3不可能引起出由b向a的变化 | |
| D. | 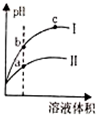 用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
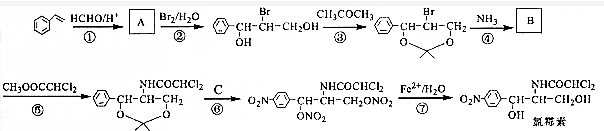
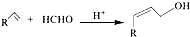
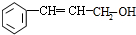 ;C的名称硝酸.
;C的名称硝酸.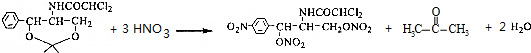 .
.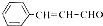 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56gFe与1 molCl2充分反应转移电子数为3NA | |
| B. | 常温常压下,22 g D3O+含有10 NA个电子 | |
| C. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02 NA | |
| D. | 1 L0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 测同温同浓度下的Na2CO3和Na2SO3水溶液的pH | 确定碳和硫两元素非金属性强弱 |
| B | 向CH2=CHCH2OH中滴加酸性KMnO4溶液 | 证明CH2=CHCH2OH中含有碳碳双键 |
| C | 取久置的Na2SO3溶于水,加硝酸酸化的BaCl2溶液 | 证明Na2SO3部分被氧化 |
| D | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 | 检验蔗糖水解产物具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(D)=0.40 mol•L-1•s-1 | B. | V (C)=0.50 mol•L-1•s-1 | ||
| C. | V(B)=1.2 mol•L-1•min-1 | D. | V(A)=0.30 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com