
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g)ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如图:

下列说法正确的是( )
A.过程Ⅰ、过程Ⅱ均为放热过程
B.图示显示:起始时的2个H2O都参与了反应
C.过程Ⅲ生成了极性键和非极性键
D.使用催化剂降低了水煤气变换反应的ΔH
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有机物A有以下一系列反应,可以转化为F,
![]()
已知E的分子式为C2H6O2,B的分子结构分析,核磁共振氢谱图中有两个峰,而且峰的面积之比为3:2。回答下列问题:
(1)A→B的反应类型是____反应,E的官能团名称是____
(2)A的结构简式为______,D的系统命名为_______
(3)写出化学方程式
①D→E___________
②B→C __________
II.某有机物的蒸气密度是相同状态下甲烷密度的5.75倍,把1.84g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱石灰,碱石灰增重4.08g,又知生成水和二氧化碳的物质的量之比为4:3,试求此有机物的分子式为_____,已知该有机物中只含一种官能团,且两个该官能团连在同一碳上的物质不稳定,则该有机物的结构简式为___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
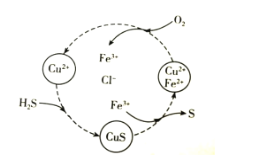
A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O2![]() 2S↓+2H2O
2S↓+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
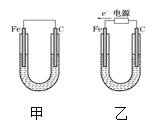
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___棒,乙装置中的____棒;
②乙装置的电化学防护法称为____,其中碳极的电极反应式是:_____。
③取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为___,发生反应的离子方程式为________
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______。
②甲装置碳极的电极反应属于_____(填“氧化反应”或“还原反应”);
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因_____
(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是(_____)
A.KI B.H2SO4 C.CuCl2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与CH2=CH2 → CH2Br—CH2Br的变化属于同一反应类型的是 ( )
A. CH2=CH2 →C2H5OHB. CH3 CH=CH2→CH2 Cl CH=CH2
C. ![]() D. CH3CH2Br→ CH3CH2OH
D. CH3CH2Br→ CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示实验装置进行物质性质的探究实验。下列说法不合理的是( )
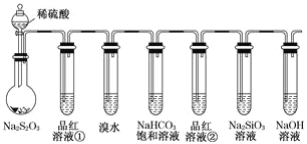
A.若品红溶液①褪色,则说明产物中含有SO2
B.若溴水褪色,则说明SO2具有还原性
C.若烧瓶中产生黄色浑浊和无色气泡,则说明Na2S2O3只作氧化剂
D.若品红溶液②不褪色、Na2SiO3溶液中出现白色浑浊,则说明硅酸比碳酸的酸性弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com