
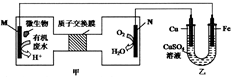
 下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )| A. | 甲中H+透过质子交换膜由左向右移动 | |
| B. | M极电极反应式:H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16e- | |
| C. | 一段时间后,乙中CuSO4溶液浓度基本保持不变 | |
| D. | 当N极消耗0.25molO2时,则铁极增重16g |
分析 根据题给信息知,甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应;乙部分是在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,以此解答该题.
解答 解:甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,
A.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,即由左向右移动,故A正确;
B.H2N(CH2)NH2在负极M上失电子发生氧化反应,生成但其、二氧化碳和水,电极反应式为H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16e-,故B正确;
C.乙部分是在铁上镀铜,电解液浓度基本不变,所以乙中CuSO4溶液浓度基本保持不变,故C正确;
D.当N电极消耗0.25 mol氧气时,则转移0.25×4=1mol电子,所以铁电极增重$\frac{1}{2}$mol×64g/mol=32g,故D错误.
故选D.
点评 本题考查了原电池原理以及电镀原理,侧重于学生的分析、计算能力的考查,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
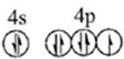 .根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I
.根据下表提供的第一电离能数,据判断,最有可能生成较稳定的单核阳离子的卤素原子是I| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和甲醇 | B. | 丙醛和丙酮 | C. | 乙烯和乙炔 | D. | 乙烯和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
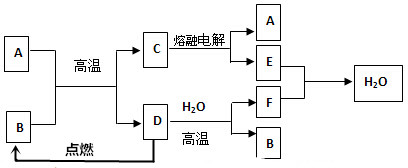
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
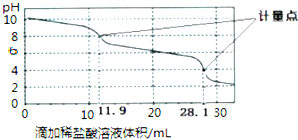
| A. | 此样品中NaHCO3的物质的量为(28.1-11.9)×10-4mol | |
| B. | 整个滴定过程中,溶液中阴离子总数始终不变 | |
| C. | 滴加稀盐酸的体积为11.90mL时:c(H+)+c(H2CO3)═c(OH-)+c(CO32-) | |
| D. | 该方法无法测定Na2CO3和NaOH混合溶液中NaOH的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com