
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
分析 A.醋酸电离平衡醋酸Ka=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,电离平衡常数只与温度有关,HCl电离出的氢离子抑制醋酸电离;
解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.二者恰好完全反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解而促进水电离,水电离出的c(H+)等于溶液中的c(OH-).
解答 解:A.电离平衡常数只与温度有关,醋酸电离平衡醋酸Ka=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,电离平衡常数只与温度有关,HCl电离出氢离子而抑制醋酸电离,醋酸根离子浓度降低、醋酸电离平衡常数不变,则溶液中c(H+)/c(CH3COOH)增大,故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),故B正确;
C.二者恰好完全反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性,则c(OH-)<(H+),所以得c(OH-)<(H+)+c(NH3•H2O),故C错误;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解而促进水电离,水电离出的c(H+)等于溶液中的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-b}}$mol/L=10b-14mol/L,故D正确;
故选C.
点评 本题考查弱电解质的电离和盐类水解,为高频考点,明确弱电解质电离特点、含有弱离子的盐对水电离的影响、溶液中存在的守恒是解本题关键,易错选项是A,注意公式的灵活运用,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素X、W的简单阴离子具有相同的电子层结构 | |
| B. | 由Y、Z两种元素组成的化合物是离子化合物 | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 原子半径:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是无色、带有特殊气味的液体 | |
| B. | 苯分子中键与键的夹角是120° | |
| C. | 苯在一定条件下能与溴发生取代反应 | |
| D. | 苯中不含碳碳双键,所以不可能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氨水混合:H++OH-═H2O | |
| B. | 金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠与过量稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气与碘化钾溶液的反应:Cl2+I-=I2+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 | |
| B. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤的方法除去 | |
| C. | 家用“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 | |
| D. | 可用蘸取浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
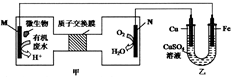 下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )
下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)NH2]氧化为环境友好物质形成的化学电源.当电池工作时,下列说法错误的是( )| A. | 甲中H+透过质子交换膜由左向右移动 | |
| B. | M极电极反应式:H2N(CH2)NH2+4H2O-16e-═2CO2↑+N2↑+16e- | |
| C. | 一段时间后,乙中CuSO4溶液浓度基本保持不变 | |
| D. | 当N极消耗0.25molO2时,则铁极增重16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{25a{V}_{0}{V}_{2}}{W{V}_{1}}$% | B. | $\frac{25a{V}_{1}{V}_{2}}{W{V}_{0}}$% | C. | $\frac{25a{V}_{1}{V}_{0}}{W{V}_{2}}$% | D. | $\frac{25a{V}_{2}}{W}$% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:W>Z | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最高价氧化物对应水物的碱性:Y<W | D. | Y、Z的氧化物都是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com