

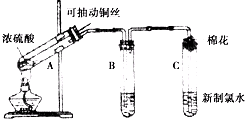
分析 (1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;铜丝完成螺旋状是为了增大与浓硫酸的接触面积增大反应速率,抽出后可以停止反应;
(2)C中浓硫酸是吸收气体中的水蒸气;
(3)二氧化硫有毒,多余的二氧化硫气体需要用氢氧化钠溶液或酸性高锰酸钾溶液吸收;
(4)根据C中氧化铜是否被还原及E中品红溶液是否褪色判断;
(5)反应后的混合液中含有浓硫酸,不能向冷却后的溶液中加水,否则会导致液体溅出,应该类比稀释浓硫酸的方法进行操作.
解答 解:Ⅰ.(1)碳和浓硫酸在加热条件下生成二氧化碳、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O,A装置铜丝如图设计的原因是增大铜与浓硫酸的接触面积,反应随时发生,随时停止,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O;增大铜与浓硫酸的接触面积,反应随时发生,随时停止;
(2)C中浓硫酸是吸收气体中的水蒸气,防止进入装置D炸裂试管,
故答案为:除去反应中产生的水蒸气;
(3)二氧化硫气体是一种有毒气体,剩余的二氧化硫气体不能直接排放,应该用NaOH溶液或酸性KMnO4溶液等吸收,
故答案为:NaOH溶液(或酸性KMnO4溶液等);
(4)由于D装置中黑色固体颜色无变化,E中溶液褪色,说明反应生成了二氧化硫,证明反应中S元素被还原,在反应中作氧化剂,而氢离子没有被还原,所以浓硫酸的中S的氧化性大于氢离子,
故答案为:D装置中黑色固体颜色无变化,E中溶液褪色;
(5)含有铜离子的溶液显示蓝色,需要将反应后的溶液用水稀释,由于反应后的溶液中含有浓硫酸,所以应该将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝,
故答案为:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
点评 本题考查了浓硫酸的性质、常见气体检验的方法和操作顺序、对实验原理的理解等,题目难度中等,注意掌握浓硫酸的性质及常见气体的检验方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 | |
| C. | 原电池中发生的反应达平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒(Se)化氢比硫化氢稳定 | B. | 钫(Fr)与水反应比钾与水反应剧烈 | ||
| C. | 铍(Be)的原子失电子能力比镁弱 | D. | 氢氧化锶(Sr)比氢氧化钙的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
查看答案和解析>>
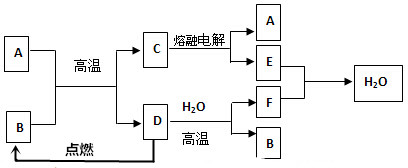
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com