
硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:①
②莫尔盐在乙醇溶剂中难溶。
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
(2)步骤3中包含的实验操作名称 。
(3)产品莫尔盐最后用 洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500 mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000 mol·L-1的酸性KMnO4溶液分三次进行滴定。
(乙)方案二:取20.00 mL硫酸亚铁铵溶液进行如下实验。

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
,验证推测的方为: 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00 mL硫酸亚铁铵溶液进行该实验。


(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为 。
【知识点】基本实验操作、离子检验、无机化合物的简单计算
【答案解析】I.(1)水浴加热(1分 )
防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出(2分)
(2)加热蒸发,浓缩结晶(2分)
(3) b(1分 )
II.(1) Fe2+已被空气部分氧化 (2分)
取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已
被空气部分氧化 (2分)
(2)①乙(1分) 甲装置会出现倒吸(1分) c (1分)
 ②
② 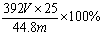 (2分)
(2分)
解析:I.(1)加热温度只有70多度,用水浴加热可以更好地控制温度;必须在铁屑少量剩余时,进行热过滤,原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出;
(2)步骤3中由溶液得晶体的实验操作是加热蒸发、浓缩结晶;(3)莫尔盐在乙醇溶剂中难溶,易溶于水,所以最后用乙醇进行洗涤;
II.(1)实验操作方案一利用高锰酸钾氧化亚铁,进行计算,方案二利用硫酸根转化成沉淀进行计算,方案一中Fe2+被空气部分氧化,会造成结果偏小;若被氧化,产物是铁离子,检验的步骤是:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(2) ①利用排液体法测量气体体积,装置甲中是水,氨气极易溶于水,会发生倒吸,装置乙最合理;量气管中最佳试剂不能吸收氨气,最好是c:CCl4溶液;
②找关系式:(NH4)2SO4•FeSO4•6H2O——2NH3
V/44.8 mol V/22.4 mol
从500mL溶液中取出20mL进行的实验,(NH4)2SO4•FeSO4•6H2O总物质的量=25×V/44.8 mol
硫酸亚铁铵晶体的纯度=25V/44.8 mol×398g/mol÷m g×100%=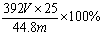 .
.
【思路点拨】本题考查了基本实验操作步骤、铁离子检验、运用关系式法进行无机化合物的简单计算,注意从题目中提取有效信息,难度中等
(二)选考题:共45分。请考生从给出的3道物理题,3道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡上选答区域指定位置答题。如果多做,则每学科按所做的第一题计分。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
标况下由0.5g H2、11g CO和4g O2组成的混合气体,其体积约为( )
|
| A. | 8.4 L | B. | 11.2 L | C. | 14.0 L | D. | 16.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是
A.某特定反应的平衡常数仅是温度的函数 B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡不一定发生移动 D.化学平衡发生移动,平衡常数不一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H22NH3是工业上合成氨的重要反应。
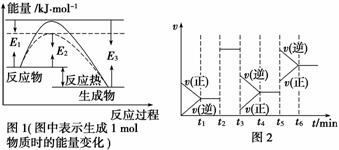
(1)根据图1请写出合成氨的热化学方 程式__________________________________(热量用E1、E2或E3表示)。
程式__________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1~t6”表示)。
(3)t3时刻改变的条件是____________, t5时刻改变的条件是____________。
t5时刻改变的条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA
C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑
D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物X的结构如下,下列说法正确的是
A. X能发生氧化、取代、酯化、加聚、缩聚反应
B. X与FeCl3溶液不能发生显色反应
C. 1mol X与足量NaOH溶液反应,最多消耗2mol NaOH
D. X的分子式为C23H26 N2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,可用做肥料、灭火剂、洗 涤剂等。制备氨基甲酸铵的化学方程式如下:2NH3(g)+CO2(g) NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
a.常温下在干燥的空气中稳定,遇水生成碳酸铵或碳酸氢铵;
b. 59℃则可分解成NH3和CO2气体;
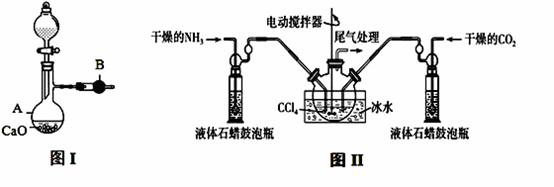
用如图I装置制备干燥的氨气,图II装置制备氨基甲酸铵,把制备的干燥的氨气和二氧化碳通入四氯化碳中不断搅拌混合,当生成的氨基甲酸铵晶体悬浮在四氯化碳中较多时停止制备(注:四氯化碳与液体石蜡均为惰性介质)。
请回答下列问题:
(1)图I中,仪器B的名称 , A中的化学反应方程式是 ;
(2)图II装置中使用冰水的原因是 ;
(3)图II中液体石蜡鼓泡瓶的作用是 ;
(4)从图II反应后的混合物中分离出产品的方法是 ;
 A.蒸馏 B.过滤 C.分液 D.结晶
A.蒸馏 B.过滤 C.分液 D.结晶
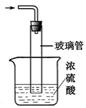
(5)图II装置中,尾气处理装置如右图所示,玻璃管的作用 ,浓硫酸的作用是 和防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品7.82 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为10.0 g,则样品中氨基甲酸铵的质量分数为 (计算结果精确至0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
某二价金属的碳酸盐和酸式碳酸盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和酸式碳酸盐的物质的量之比是 ( )
A.1:1 B.1:2 C.1: 3 D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
葛根素具有降血压等作用,其结构简式如下图,下列有关说法正确的是
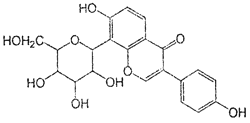
A.该物质在一定条件下能发生消去反应、加成反应、取代反应
B.葛根素的分子式为C21H22O9
C.该物质一个分子中含有5个手性碳原子
D.一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com