
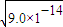 =3×10-7 mol/L,溶液的pH=7-lg3,根据溶液的pH与中性溶液的pH比较判断溶液的酸碱性;
=3×10-7 mol/L,溶液的pH=7-lg3,根据溶液的pH与中性溶液的pH比较判断溶液的酸碱性;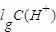 计算;
计算;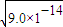 =3×10-7 mol/L,溶液的pH=7-lg3,pH=7>7-lg3,则该溶液呈碱性,故答案为:碱性;
=3×10-7 mol/L,溶液的pH=7-lg3,pH=7>7-lg3,则该溶液呈碱性,故答案为:碱性;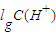 =-lg0.01=2,故答案为:2;
=-lg0.01=2,故答案为:2;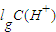 =-
=-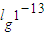 =13,则溶液中c(OH-)=
=13,则溶液中c(OH-)=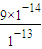 =0.9mol/L,
=0.9mol/L,

 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
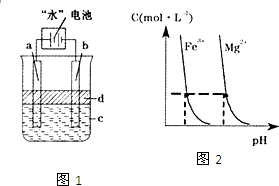 “水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有
“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com