
【题目】方法与规律提炼:
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
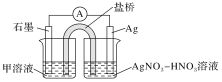
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是_________________________
(2)用零价铁(Fe)去除水体中的硝酸盐(NO![]() )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
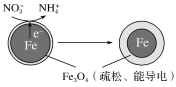
上图中作负极的物质是___________。正极的电极反应式是______________。
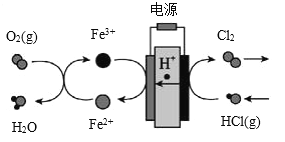
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。 电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
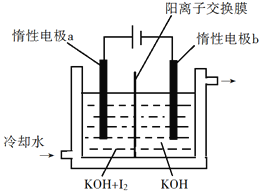
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____
【答案】负 FeSO4 或FeCl2溶液 分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深 铁 NO3-+8e-+10H+=NH4++3H2O Fe3++e-= Fe2+ 5.6L 2H++2e-= H2 ↑ K+ a→b 原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。
【解析】
根据原电池原理,负极发生氧化反应;根据电解池原理,阴极发生还原反应,通过物质的化合价变化判断反应发生原理,阳离子移动方向与电子移动方向相同,据此回答问题。
(1) 已知电池总反应为反应Ag++Fe2+=Ag+Fe3+,银离子化合价降低,得到电子,作正极,故石墨一侧仅为导电材料,作负极,甲溶液是含Fe2+的溶液,可以为FeSO4 或FeCl2溶液。证明反应能够发生,实际上即证明有Fe3+生成,实验操作及现象是分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深。
(2) 由图可知,电子从铁电极移到外侧,故铁电极失去电子,发生氧化反应,做负极。正极NO3-得到电子变为NH4+,NO3-+8e-+10H+=NH4++3H2O;
(3)由题可知,HCl失去电子变为Cl2,发生氧化反应,做阳极。阴极区的电极反应式为Fe3++e-= Fe2+, 外侧Fe2+与氧气反应4Fe2++O2+4H+= 4Fe3++2H2O,电路中转移1 mol电子,需消耗氧气0.25mol,即5.6L(标准状况)。
(4)由图可知, 阴极溶液为KOH,根据阳离子放电顺序H+>K+,即电解时阴极的电极反应式为2H++2e-= H2 ↑。阴极得到电子,阳离子向阴极移动,即电解过程中通过阳离子交换膜的离子主要为K+,其迁移方向是a→b。
归纳电极反应式的书写方法:原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油。(流程示意图如下,反应③的H2也由反应①得到。)
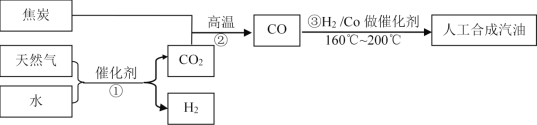
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油。
(1)通过计算说明上述方案能否得到理想的产品_______________。
(2)当CO2的使用量应控制为反应①中CO2产量的______________(填比例范围),可以得到理想的产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-羟基丁酸(3-hydroxybutyrate)也称为β-羟基丁酸(beta-hydroxybutyrate),在工业中可用于合成可生物降解的塑料,如聚(3-羟基丁酸)。
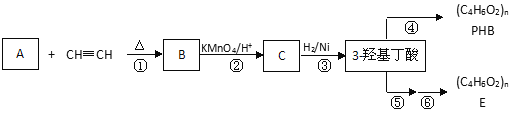
已知:i. 共轭二烯烃(如异戊二烯)与含有碳碳叁键的有机物作用时能形成环状化合物:
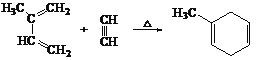
ii. 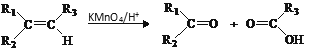
iii. 步骤②只有一种产物;E的结构中含有甲基
(1)A分子结构简式 _______;理论上B也可以由1,3-丁二烯与烃F来合成,则F的名称(系统命名法):_________;C中含有的官能团是_______(用符号表示)。
(2)写出反应类型:②_____________, ④_____________。
(3)PHB______(填“有”或“无”)固定熔沸点;它与E______(填“互为”或“不互为”)同分异构体。下列有机物具有类似共轭二烯烃性质的是__________(填序号);
a. ![]() b.
b. ![]()
c. ![]() d.
d. 
(4)写出反应⑤的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜( 阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是

A. 电极a为粗铜,电极b为精铜
B. 甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
C. 乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区
D. 当电路中通过1mol电子时,可生成32g精铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在加热固体NH4Al(SO4)212H2O时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4)3,下列判断正确的是( )
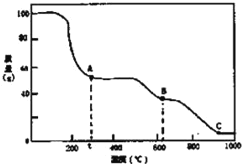
A.0℃→t℃的过程变化是物理变化
B.C点物质是工业上冶炼铝的原料
C.A→B反应中生成物只有Al2(SO4)3和NH3两种
D.Al2(SO4)3能够净水,其原理为:Al3++3OH-![]() Al(OH)3
Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
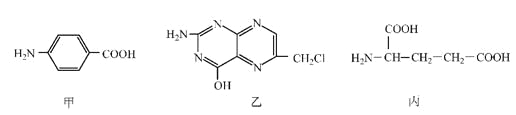
(1)甲中显酸性的官能团是_______________(填名称)。
(2)下列关于乙的说法正确的是__________________(填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________________。
a.含有![]() b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
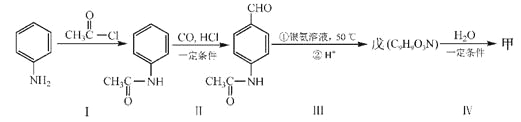
①步骤I的反应类型是______________________。
②步骤I和Ⅳ在合成甲过程中的目的是____________________。
③步骤Ⅳ反应的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
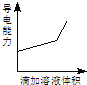
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以乙烯等为主要原料合成药物普鲁卡因:
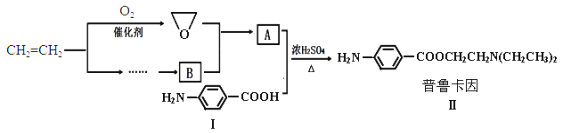
已知:![]() ,
,![]()
(1)对于普鲁卡因,下列说法正确的是___。
a.一个分子中有11个碳原子
b.不与氢气发生加成反应
c.可发生水解反应
(2)化合物Ⅰ的分子式为___,1mol化合物Ⅰ能与___molH2恰好完全反应。
(3)化合物Ⅰ在浓H2SO4和加热的条件下,自身能反应生成高分子聚合物Ⅲ,写出Ⅲ的结构简式___。
(4)请用化学反应方程式表示以乙烯为原料制备B(无机试剂任选)的有关反应,并指出所属的反应类型___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com