
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
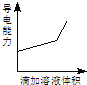
A.AB.BC.CD.D
【答案】BD
【解析】
A.浓度为0.1mol/L的盐酸,滴加同浓度的氢氧化钠溶液,生成氯化钠,溶液的体积变大,导致离子浓度减小,导电能力减弱,故A错误;
B.醋酸是弱电解质部分电离,向其中滴入氢氧化钠,生成的醋酸钠为强电解质,自由移动离子浓度增大,导电能力增强,故B正确;
C.氢氧化钠和氨水不反应,氨水是弱电解质,向氢氧化钠溶液中滴入氨水,相当于对氢氧化钠稀释,离子浓度减小,导电能力减弱,故C错误;
D.向氨水中滴入硝酸银,形成银铵络离子,先产生白色沉淀AgNO3+NH3H2O=AgOH+NH4NO3,继续滴加氨水,沉淀消失,发生AgOH+2NH3H2O=[Ag(NH3)2]OH +2H2O,而[Ag(NH3)2]OH是一元强碱,导致离子浓度增大,导电能力增强,故D正确;
选BD。


科目:高中化学 来源: 题型:
【题目】铅是一种金属元素,可用作耐酸腐蚀、蓄电池等的材料。其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等。
(1)铅元素位于元素周期表第六周期IVA。IVA中原子序数最小的元素的原子有_______种能量不同的电子,其次外层的电子云有_______种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是______(填化学式),气态氢化物沸点最低的是_____________(填化学式)。
(3)配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
__PbO2+___MnSO4+___HNO3 →___HMnO4+___Pb(NO3)2+___PbSO4↓+____ ____
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol·L-1,则反应中转移的电子数为_______个。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______
A. PbO2+4HCl→PbCl4+2H2O B. PbO2+4HCl→PbCl2+ Cl2↑+2H2O
C. PbO2+2HCl+2H+→PbCl2+2H2O D. PbO2+4HCl→PbCl2+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方法与规律提炼:
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
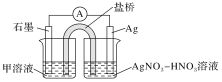
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是_________________________
(2)用零价铁(Fe)去除水体中的硝酸盐(NO![]() )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
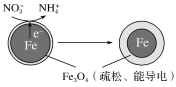
上图中作负极的物质是___________。正极的电极反应式是______________。
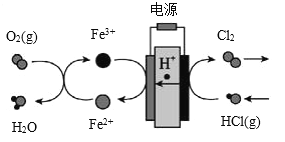
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。 电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
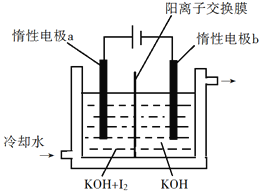
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,常温下均为气体,在自来水消毒和果蔬保鲜等方面应用广泛某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究
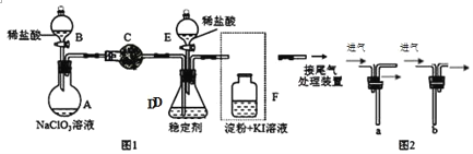
(1)仪器C的名称是:___安装F中导管时,应选用图2中的:___(填“a”或“b”)。
(2)打开B的活塞,A中氯酸钠和稀盐酸混和产生Cl2和ClO2,写出反应化学方程式:___;为使ClO2在D中被稳定剂充分吸收,可采取的措施是___
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是:___。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为:___,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是:___
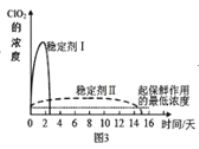
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是___,(选填“I”或“II”)理由是:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质 | 溶解度( g/100g水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 87 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢与浓硫酸发生如下反应:H2S+H2SO4(浓)→S↓+SO2↑+2H2O加热条件下,单质硫与浓硫酸又会发生如下反应:S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
计算:
(1)若98%浓硫酸可表示为H2SO4aH2O,则a=__;若要把该浓硫酸转化为H2SO4H2O,则98%浓硫酸与加入水的质量比为_____。
(2)一定条件下,将0.1mol H2S气体通入足量浓硫酸中,生成b mol SO2,则 b的取值范围是_______。
(3)在50mL、4.0mol/L的NaOH溶液中,通入H2S气体并充分反应,然后,小心蒸发,得到不含结晶水的白色固体.通入H2S的物质的量为x mol,生成的白色固体的质量为7.9g,通过计算确定白色固体的可能成分及每种成分的质量(结果保留一位小数)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是与硫同主族的元素。
已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
(1)通过以上反应判断SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是___。
工业上回收得到的SeO2样品混有其它杂质,可以通过下面的方法测定SeO2含量:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
(2)配平反应式①,标出电子转移的方向和数目___。
(3)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为___。
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(4)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是___溶液;各取5mL上述溶液,分别加热(温度相同),pH较小的是___溶液。
(5)取5mLNH4Cl溶液,加水稀释至50mL,c(H+)___10-6mol/L(填“>”、“<”或“=”),![]() ___填“增大”、“减小”或“不变”)。
___填“增大”、“减小”或“不变”)。
(6)向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸。
①在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为___(选填字母)。
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-) b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] d.2c(Na+)=c(H2S)+c(HS-)+2c(S2-)
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是___(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com