
【题目】纯碱晶体![]() 样品中常混有NaCl等杂质。某同学用沉淀法测定样品中
样品中常混有NaCl等杂质。某同学用沉淀法测定样品中![]() 的质量分数,操作流程如下:
的质量分数,操作流程如下:
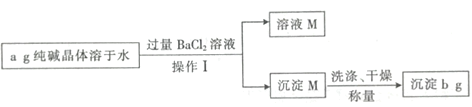
(1)写出加入![]() 溶液反应的离子方程式____;操作I所用到的玻璃仪器有烧杯、玻璃棒、____。
溶液反应的离子方程式____;操作I所用到的玻璃仪器有烧杯、玻璃棒、____。
(2)对沉淀M洗涤的方法是___。
(3)样品中![]() 的质量分数为___。
的质量分数为___。
(4)如果纯碱晶体失去部分结晶水(风化),则测定结果会___(填“偏高”、“偏低”或“不变”)。
(5)纯碱在生产生活中有广泛应用,用途正确的是_____。
A 用于治疗胃酸过多 B 用于生产玻璃 C 用于造纸 D 用于焙制糕点
【答案】CO32-+Ba2+=BaCO3↓ 漏斗 沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作2~3次,直至洗涤干净即可 ![]() % 偏高 BC
% 偏高 BC
【解析】
根据流程图可知,纯碱晶体样品中常混有NaCl等杂质,溶于水后形成碳酸钠与氯化钠的混合溶液,加入过量氯化钡溶液,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,经过滤操作得沉淀M为碳酸钡,溶液M为氯化钠与氯化钡的混合溶液,据此回答。
根据流程图可知,纯碱晶体样品中常混有NaCl等杂质,溶于水后形成碳酸钠与氯化钠的混合溶液,加入过量氯化钡溶液,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,经过滤操作得沉淀M为碳酸钡,溶液M为氯化钠与氯化钡的混合溶液;
(1)碳酸钠与氯化钡反应的离子方程式为:CO32-+Ba2+=BaCO3↓,操作Ⅰ为过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗;故答案为:CO32-+Ba2+=BaCO3↓;漏斗;
(2)洗涤沉淀的方法是:沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作2~3次,直至洗涤干净即可;故答案为:沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作2~3次,直至洗涤干净即可;
(3)由分析可知,碳酸钡质量为bg,n(BaCO3)=![]() =
=![]() mol,则n(Na2CO3)= n(BaCO3)=
mol,则n(Na2CO3)= n(BaCO3)=![]() mol,m(Na2CO3)=
mol,m(Na2CO3)=![]() mol
mol![]() =
=![]() g,质量分数为:
g,质量分数为: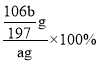 =
=![]() %;故答案为:
%;故答案为:![]() %;
%;
(4)如果纯碱晶体失去部分结晶水,则样品质量偏小,会导致测定结果偏高;故答案为:偏高;
(5)纯碱主要应用于玻璃制造业、化学工业、冶金工业、以及造纸、肥皂、纺织、印染、食品等轻工业,小苏打可以用于治疗胃酸过多和焙制糕点,故答案为:BC。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是

A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法不正确的是( )

A.电池总反应式为:2Mg+ O2+2H2O=2Mg(OH)2
B.正极反应式为:Mg-2e-=Mg2+
C.活性炭可以加快O2在电极上的反应速率
D.电子的移动方向由a经外电路到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的一种工业生产过程如下:

下列说法中错误的是
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.“碱化”目的是让可溶性有机质形成沉淀
D.“氧化”是让I-转化为I2,可以用适量氯气作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示。下列说法中不正确的是( )

A. 该分子的分子式为C5H4
B. 该分子中碳原子的化学环境有2种
C. 该分子中的氢原子分布在两个相互垂直的平面上
D. 该分子中只有C—C键,没有![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
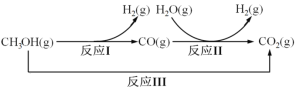
(1)已知一定条件下
反应I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
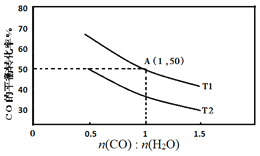
①比较T1、T2的大小,并解释原因___。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡。
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)__v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)在经CO2饱和处理的KHCO3电解液中,电解活化CO2可以制备乙醇,原理如图所示。
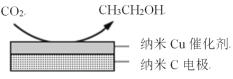
①阴极的电极反应式是___。
②从电解后溶液中分离出乙醇的操作方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
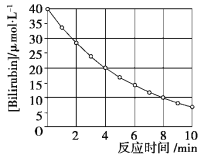
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com