
| ||
| ||
| 10.7g |
| 53.5g/mol |


科目:高中化学 来源: 题型:
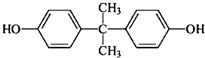 是一种重要的有机化工原料.双酚A的合成一般是在质子酸的催化下,由苯酚和丙酮缩合而成的.某中学研究性学习小组在查阅了有关文献后,拟按下列流程合成双酚A(实验中所用丙酮过量).
是一种重要的有机化工原料.双酚A的合成一般是在质子酸的催化下,由苯酚和丙酮缩合而成的.某中学研究性学习小组在查阅了有关文献后,拟按下列流程合成双酚A(实验中所用丙酮过量).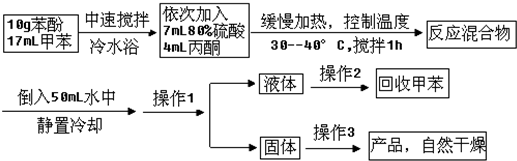
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)根据上述实验,写出SOCl2和水反应的化学方程式:________________________。
(2)由于ZnCl2溶液蒸干灼烧后,得不到无水ZnCl2固体,只能得到ZnCl2水解的产物Zn(OH)Cl。所以,工业上往往用ZnCl2的水合晶体ZnCl2·xH2O和SOCl2混合共热来制取无水ZnCl2。在这种制法中SOCl2与晶体中结晶水反应的生成物使ZnCl2的水解被抑制,故可得无水ZnCl2。试解释灼烧过程中SOCl2抑制ZnCl2水解的原因:____________________
_________________________。
(3)SOCl2还能和某些含羟基的有机物反应,如它与乙醇的反应可表示为:
C2H5OH+SOCl2![]() C2H5Cl+SO2+HCl
C2H5Cl+SO2+HCl
和该反应相似,当过量的SOCl2跟苯甲酸混合,稍加热即发生反应,苯甲酸完全转化成一种沸点为197 ℃的液态有机物。该反应的化学方程式可表示为:_______________________。
为了使生成的有机物与混溶于其中的SOCl2分离,可以使用下列中______方法。
A.过滤 B.分液 C.蒸发结晶 D.蒸馏
查看答案和解析>>
科目:高中化学 来源:2010年江苏省盐城市高三上学期摸底考试化学试题 题型:填空题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.用于合成氨的工业煤气中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)钴原子在基态时核外电子排布式为 。
(2)下列有关分子结构的说法正确的是 。
A.C2H4分子中有5个 键处1个
键处1个 键
键
B.COS分子(结构如右图)中键能C=O>C=S
C.H2S分子呈V形结构
D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是 。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:Cs2>COS >CO2
>CO2
C.相同压强下沸点:C2H 5SH>C2H5OH
5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4) -ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
-ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于 。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]·8H2O,中心原子的配位数为 。
B.烃醛结合反应有机合成中颇为重要,绿色催化剂的固体铌酸酸倍受研究者关注。铌酸具有较高的催化活性及稳定性。反应原理如下:
实验方法是在25mL烧瓶中加入铌酸、10mL甲醇和 0.5mL苯甲醛,在回流状态下反应2h,反应的产率和转化率均非常高。
(1)采用回流反应2h的目的是 。
(2)在反应中甲醇需过量,其原因是 。 (3)不同铌酸用量对产率和转化率影响,如下表:
(3)不同铌酸用量对产率和转化率影响,如下表:
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 邻羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列实验操作中,合理的是 ( )
A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混
合物,使液体温度迅速升到170℃
B.实验室制取肥皂时,待植物油、乙醇和氢氧化钠溶液的混合物加热充分反
应后,冷却,用纱布滤出固态物质
C.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、
静置、待液体分层后,滴加硝酸银溶液
D.验证蔗糖水解产物时,在蔗糖溶液中加入几滴稀硫酸,水浴5 min,加入
新制银氨溶液
(2)今有化合物

①写出丙中含氧官能团的名称:丙_____________________。
②三种物质中互为同分异构体的为__________________。
③请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法: 。
鉴别乙的方法: 。
鉴别丙的方法: 。
④请按羟基上氢原子的活泼性由强至弱排列甲、乙、丙的顺序: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com