
【题目】利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )

A.通电后,电解质溶液中的电子由阳极移到阴极
B.铜牌与电源正极相连
C.该电解池的阴极反应可表示为Cu2++2e-=Cu
D.当电镀一段时间后,电解质溶液中c(Ag+)保持不变
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】《Inorganic Syntheses》(无机合成)一书中,有一如图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是( )
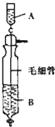
A.A中装浓盐酸,B中装浓硫酸
B.A中装浓硫酸,B中装浓盐酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比![]() 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时,![]() 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g) + O2(g) ![]() 2SO3(g) + Q kJ(Q>0)。在10 L恒温恒容密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0. 025 Q kJ。下列判断正确的是
2SO3(g) + Q kJ(Q>0)。在10 L恒温恒容密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0. 025 Q kJ。下列判断正确的是
A.在2 min内,O2的转化率为25%
B.在1min时,c(SO2) + c(SO3) = 0.01 mol/L
C.若再充入0.1 mol SO3,达到平衡后SO3的质量分数会减小
D.向该容器中再加入0.1 mol SO2和0.05 mol O2,平衡后反应放热大于0.05Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某粒子的核外电子排布式为![]() ,回答下列问题:
,回答下列问题:
(1)若该粒子为电中性粒子,则这种粒子的符号是______
(2)若该粒子形成的盐溶液能与溴水反应使溴水褪色,并出现浑浊,则这种粒子的符号是______
(3)若该粒子的还原性较弱,且这种元素的原子得到一个电子即达最外层8电子的稳定结构,则这种粒子的符号是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往硫酸与硝酸的混合溶液中投入一块未除氧化膜的铝箔,微热使之完全反应,产生2.24 L (已折算为标准状况)NO与H2的混合气体,且该混合气体的平均摩尔质量为13.20 g/mol。
(1)混合气体中NO的体积分数为_________。
(2)若将所得混合气体与一定量的氧气在一定条件下充分反应后,恰好全部转化为硝酸溶液。则所用氧气在标准状况下的体积为_________L。
(3)向铝箔与混酸反应后的溶液中趁热加入一定质量的(NH4)2SO4,冷却后全部溶液正好转化为40.77 g铝铵矾晶体[化学式:NH4Al(SO4)2·12H2O,式量:453]。
①原铝箔中金属铝的质量为_________g。氧化膜的物质的量为___________mol。
②计算原混酸中硫酸的质量分数(保留三位小数,写出计算过程)。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
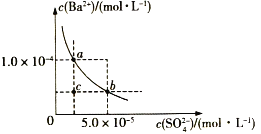
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
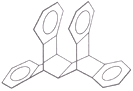
A.Janusene的分子式为C30H24
B.一定条件下1mol Janusene能与3mol氢气发生加成
C.Janusene苯环上的一氯代物有6种
D.Janusene既可发生氧化反应,也可发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10min时,平均反应速率υ(NO2) = ____________________ ,电子转移了 ___________ 个。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是____________。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2)正 = 7v(N2)逆
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_________ (填增大、不变、减小),NO2的转化率 ______________。
(4)一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
a.一定向正反应方向移动 b. 平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com