
【题目】往硫酸与硝酸的混合溶液中投入一块未除氧化膜的铝箔,微热使之完全反应,产生2.24 L (已折算为标准状况)NO与H2的混合气体,且该混合气体的平均摩尔质量为13.20 g/mol。
(1)混合气体中NO的体积分数为_________。
(2)若将所得混合气体与一定量的氧气在一定条件下充分反应后,恰好全部转化为硝酸溶液。则所用氧气在标准状况下的体积为_________L。
(3)向铝箔与混酸反应后的溶液中趁热加入一定质量的(NH4)2SO4,冷却后全部溶液正好转化为40.77 g铝铵矾晶体[化学式:NH4Al(SO4)2·12H2O,式量:453]。
①原铝箔中金属铝的质量为_________g。氧化膜的物质的量为___________mol。
②计算原混酸中硫酸的质量分数(保留三位小数,写出计算过程)。___________。
【答案】40% 1.344L 2.16g 0.005mol ![]()
【解析】
(1)根据总物质的量及平均摩尔质量列方程组解得;(2)根据原子守恒分析解答;(3)根据反应中元素守恒及转移电子守恒分析解答。
(1)混合气体的物质的量为![]() ,令NO与H2的物质的量分别为xmol、ymol,则:x+y=0.1,
,令NO与H2的物质的量分别为xmol、ymol,则:x+y=0.1,![]() ,联立方程,解得x=0.04,y=0.06,故NO的体积分数为
,联立方程,解得x=0.04,y=0.06,故NO的体积分数为![]() ,故答案为:40%;
,故答案为:40%;
(2)NO转化为HNO3,H2中氢原子反应后存在于HNO3、H2O中,由(1)中计算可知n(NO)=0.04mol、n(H2)=0.06mol,由氮原子守恒可得n(HNO3)=n(NO)=0.04mol,由H原子守恒可知2n(H2)=2n(H2O)+n(HNO3),即0.06mol×2=2n(H2O)+0.04mol,解得n(H2O)=0.04mol,根据氧原子守恒有:2n(O2)+n(NO)=3n(HNO3)+n(H2O),故2n(O2)+0.04mol=3×0.04mol+0.04mol,解得n(O2)=0.06mol,故V(O2)=0.06mol×22.4L/mol=1.344L,故答案为:1.344L;
(3)①根据电子转移守恒,铝箔中n(Al)=![]() ,故m(Al)=0.08mol×27g/mol=2.16g,40.77g铝铵矾晶体的物质的量为
,故m(Al)=0.08mol×27g/mol=2.16g,40.77g铝铵矾晶体的物质的量为![]() ,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,故答案为:2.16g;0.005mol;
,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,故答案为:2.16g;0.005mol;
②根据铵根守恒可知n[(NH4)2SO4]=![]() ,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×20.045mol=0.135mol,故m(H2SO4)=0.135×98g=13.23g,m(Al2O3)=0.005mol×102g/mol=0.51g,m(混酸)+m(铝箔)+m[(NH4)2SO4]m(气体)=m(铝铵矾晶体),故m(混酸)+2.1g+0.51g+5.94g0.1mol×13.2g/mol=40.77g,故m(混酸)=40.77g2.16g0.51g5.94g+0.1mol×13.2g/mol=33.48g,故原混酸中硫酸的质量分数为
,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×20.045mol=0.135mol,故m(H2SO4)=0.135×98g=13.23g,m(Al2O3)=0.005mol×102g/mol=0.51g,m(混酸)+m(铝箔)+m[(NH4)2SO4]m(气体)=m(铝铵矾晶体),故m(混酸)+2.1g+0.51g+5.94g0.1mol×13.2g/mol=40.77g,故m(混酸)=40.77g2.16g0.51g5.94g+0.1mol×13.2g/mol=33.48g,故原混酸中硫酸的质量分数为![]() ,故答案为:
,故答案为:![]() 。
。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是 (填序号)。
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都在同一条直线上,则A的结构简式为 。
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A最多可与1mol H2加成,则A的名称是 。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为 ;若其苯环上的一溴代物只有一种,则符合此条件的烃B有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
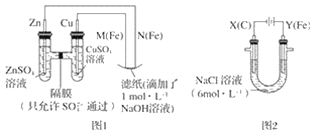
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如己烷变成苯,庚烷变成甲苯等。又知丙烯的化学性质和乙烯相似,请根据如图,回答有关问题:
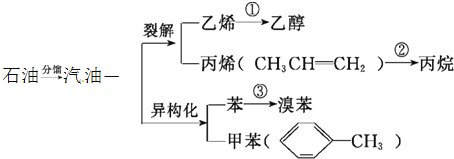
(1)写出相应的化学方程式:
![]() ______;
______;
![]() ______;
______;
![]() ______;
______;
(2)甲苯分子里苯环上一个氢原子被硝基取代后的产物有 ______ 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )

A.通电后,电解质溶液中的电子由阳极移到阴极
B.铜牌与电源正极相连
C.该电解池的阴极反应可表示为Cu2++2e-=Cu
D.当电镀一段时间后,电解质溶液中c(Ag+)保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法正确的是( )
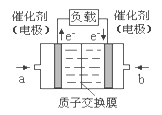
A.电解质溶液中,H+向左移动
B.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
C.b处通入甲醇,a处通入空气
D.正极反应式为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.酸式滴定管准确量取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、_______________、F(填序号)
(2)滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 20.20mL | 38.80mL |
根据以上数据可以计算出盐酸的物质的量浓度为_______________mol·L-1. (计算结果小数点后保留两位有效数字)
(3)达到滴定终点的标志是________________________________
(4)以下操作造成测定结果偏高的原因可能是___________________。
A. 取待测液时,未用待测夜润洗酸式滴定管
B. 滴定前读数时,俯视滴定管的刻度,其它操作均正确
C. 滴定管滴定前无气泡,滴定后有气泡
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。
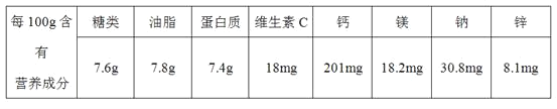
该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com