
【题目】汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如己烷变成苯,庚烷变成甲苯等。又知丙烯的化学性质和乙烯相似,请根据如图,回答有关问题:
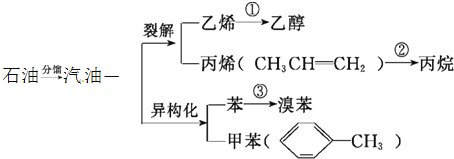
(1)写出相应的化学方程式:
![]() ______;
______;
![]() ______;
______;
![]() ______;
______;
(2)甲苯分子里苯环上一个氢原子被硝基取代后的产物有 ______ 种。
【答案】CH2=CH2+H2O![]() CH3CH2OH CH3-CH=CH2+H2
CH3CH2OH CH3-CH=CH2+H2![]() CH3-CH2-CH3 C6H6+Br2
CH3-CH2-CH3 C6H6+Br2![]() C6H5Br+HBr 3
C6H5Br+HBr 3
【解析】
石油分馏得到汽油,汽油裂解得到乙烯和丙烯,乙烯和水在一定条件下加成反应生成乙醇,丙烯和氢气加成反应生成丙烷,汽油异构化得到苯和甲苯,苯和液溴加入铁粉发生取代反应生成溴苯,据此解答。
(1)①乙烯和水在催化剂作用下发生加成反应生成乙醇,反应的化学方程式为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
②丙烯和氢气在催化剂作用下发生加成反应生成丙烷,反应的化学方程式为:CH3-CH=CH2+H2![]() CH3-CH2-CH3;
CH3-CH2-CH3;
③苯和液溴在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2![]() C6H5Br+HBr;
C6H5Br+HBr;
(2)甲苯分子里苯环上一个氢原子被硝基取代后的产物有邻、间、对3种;故答案为:3。


科目:高中化学 来源: 题型:
【题目】Ⅰ.已知NH3H2O与醋酸的电离度在同温同浓度下相等。向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。
甲同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4++H2O![]() NH3H2O+H+ (2)
NH3H2O+H+ (2)
H++OH-![]() H2O (3)
H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4Cl=NH4++Cl- (2)
NH4++OH-![]() NH3H2O (3)
NH3H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确。
(1)他选用的试剂是__________(填写编号)。
A. NH4NO3 B. CH3COONH4 C. Na2CO3 D. NH3H2O
(2)实验步骤:____________________________;
(3)实验结论:____________________________。
Ⅱ.关于“电解氯化铜溶液时的pH变化”问题,化学界有两种不同的观点。
观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高;
观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时的pH的变化如图。请回答下列问题:
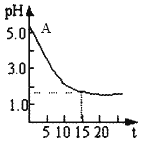
(1)用离子方程式表示电解前氯化铜溶液的pH处于A点的原因:______________。
(2)“理论派”所持观点的理论依据是:_______________________。
(3)你支持哪种观点:_________(理论派、实验派)。其理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A. 绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
B. 五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
C. 三聚氰胺分子结构如图所示 ,分子式是C3H6N6
,分子式是C3H6N6
D. 氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)的化合物丰富多彩,砷的氧化物的分子结构如图。GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似,下列说法错误的是

A.砷的氧化物是分子晶体B.砷氧化物的分子式为As6O4
C.GaAs是原子晶体D.熔、沸点:GaAs>砷的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g) + O2(g) ![]() 2SO3(g) + Q kJ(Q>0)。在10 L恒温恒容密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0. 025 Q kJ。下列判断正确的是
2SO3(g) + Q kJ(Q>0)。在10 L恒温恒容密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0. 025 Q kJ。下列判断正确的是
A.在2 min内,O2的转化率为25%
B.在1min时,c(SO2) + c(SO3) = 0.01 mol/L
C.若再充入0.1 mol SO3,达到平衡后SO3的质量分数会减小
D.向该容器中再加入0.1 mol SO2和0.05 mol O2,平衡后反应放热大于0.05Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z代表三种元素。已知:①![]() 和
和![]() 两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9;③Y和Z两种元素可以形成4核42电子的
两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9;③Y和Z两种元素可以形成4核42电子的![]() 价阴离子。
价阴离子。
(1)Y元素是______(填元素符号,下同),其原子的核外电子排布式为______,Z元素是______,其原子结构示意图为______
(2)由X、Y、Z三种元素形成的含68个电子的盐类化合物的化学式是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往硫酸与硝酸的混合溶液中投入一块未除氧化膜的铝箔,微热使之完全反应,产生2.24 L (已折算为标准状况)NO与H2的混合气体,且该混合气体的平均摩尔质量为13.20 g/mol。
(1)混合气体中NO的体积分数为_________。
(2)若将所得混合气体与一定量的氧气在一定条件下充分反应后,恰好全部转化为硝酸溶液。则所用氧气在标准状况下的体积为_________L。
(3)向铝箔与混酸反应后的溶液中趁热加入一定质量的(NH4)2SO4,冷却后全部溶液正好转化为40.77 g铝铵矾晶体[化学式:NH4Al(SO4)2·12H2O,式量:453]。
①原铝箔中金属铝的质量为_________g。氧化膜的物质的量为___________mol。
②计算原混酸中硫酸的质量分数(保留三位小数,写出计算过程)。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

①M极发生的电极反应式为___________________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18个纵行,下图实线表示元素周期表的边界。按核外电子排布,可把元素周期表里的元素划分为![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区等。除
区等。除![]() 区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
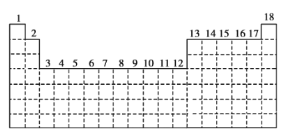
(1)请在上图中用实线画出![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区的边界线,并分别用阴影
区的边界线,并分别用阴影![]() 和
和![]() 表示
表示![]() 区和
区和![]() 区________。
区________。
(2)有的同学受这种划分的启发,认为![]() 区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
(3)请在上述元素周期表中用元素符号标出![]() 轨道处于半充满状态的元素________。
轨道处于半充满状态的元素________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com