
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

①M极发生的电极反应式为___________________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)____克。
【答案】 CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 BC 0.65 0.0425mol/(L·min) 0.96 SO2+2H2O-2e- =SO42- +4H+ 增大 6.2
【解析】(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574 kJmol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJmol-1,③H2O(g)═H2O(l)△H=-44.0 kJmol-1,根据盖斯定律,将![]() ×(①+②+③×4)得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=
×(①+②+③×4)得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=![]() ×[(-574 kJmol-1)+(-1160 kJmol-1)+(-44.0 kJmol-1)×4]=-955kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJmol-1;
×[(-574 kJmol-1)+(-1160 kJmol-1)+(-44.0 kJmol-1)×4]=-955kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJmol-1;
(2)①反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②A.图中曲线属于描点法所得图像,P点不一定为图像的最高点,即不一定为平衡状态点,可能是建立平衡过程中的一点,故A错误;B.根据图像,温度高于200℃后,2O3(g) ![]() 3O2(g)反应进行程度加大,体系中的臭氧浓度减小,NO和SO2的转化率随温度升高显著下降、当臭氧完全分解,则二者转化率几乎为零,故B正确;C.其它条件不变,若缩小反应器的容积,使得2O3(g)
3O2(g)反应进行程度加大,体系中的臭氧浓度减小,NO和SO2的转化率随温度升高显著下降、当臭氧完全分解,则二者转化率几乎为零,故B正确;C.其它条件不变,若缩小反应器的容积,使得2O3(g) ![]() 3O2(g)平衡逆向移动,臭氧浓度增大,反应Ⅰ:NO(g)+ O3(g)
3O2(g)平衡逆向移动,臭氧浓度增大,反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) 和反应Ⅱ:SO2(g)+ O3(g)
NO2(g)+O2(g) 和反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g)平衡正向移动, NO和SO2的转化率提高,故C正确;故选BC;
SO3(g)+O2(g)平衡正向移动, NO和SO2的转化率提高,故C正确;故选BC;
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJmol-1
③反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g)中NO的转化率为85%,则反应的NO为0.85mol,O3为0.85mol;反应Ⅱ:SO2(g)+ O3(g)
NO2(g)+O2(g)中NO的转化率为85%,则反应的NO为0.85mol,O3为0.85mol;反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g)中SO2的转化率为30%,反应的SO2为0.3mol,O3为0.3mol,2O3(g)
SO3(g)+O2(g)中SO2的转化率为30%,反应的SO2为0.3mol,O3为0.3mol,2O3(g) ![]() 3O2(g)中发生分解反应的臭氧占充入臭氧总量的10%,为0.2mol,则体系中剩余O3的物质的量=2.0mol-0.85mol-0.3mol-0.2mol=0.65mol;NO的平均反应速率=
3O2(g)中发生分解反应的臭氧占充入臭氧总量的10%,为0.2mol,则体系中剩余O3的物质的量=2.0mol-0.85mol-0.3mol-0.2mol=0.65mol;NO的平均反应速率=![]() =0.0425mol/(L·min);平衡是为0.85mol+0.30mol+0.3mol=1.45mol,反应Ⅱ的平衡常数=
=0.0425mol/(L·min);平衡是为0.85mol+0.30mol+0.3mol=1.45mol,反应Ⅱ的平衡常数=![]() =0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
=0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
(3)①本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,故答案为:SO2+2H2O-2e -═SO42-+4H+;
②负极反应式为:SO2+2H2O-2e -═SO42-+4H+,正极反应式为O2 + 4e-- + 4H+ == 2H2O,当外电路通过0.2 mol电子时,负极反应的二氧化硫为0.1mol,质量为6.4g,同时有0.2mol氢离子通过质子交换膜进入右侧,左侧溶液质量增大6.4g-0.2g=6.2g,故答案为:增大;6.2。


科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,其结构如图,对杀伤肿瘤细胞有独特作用。下列有关汉黄芩素的叙述不正确的是

A. 该物质属于芳香族化合物 B. 汉黄芩素的分子式为C16H13O5
C. 1mol该物质与氢氧化钠溶液反应,最多消耗2molNaOH D. 与足量H2发生加成反应后,该分子中官能团的种类减少2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是

A. 维生素C中含有3种官能团
B. 维生素C分子式为C6H8O6
C. 维生素C能使酸性高锰酸钾溶液褪色
D. 维生素C在碱性溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据价层电子对互斥理论及原子的杂化轨道理论判断NF3分子的空间构型和中心原子的杂化方式为( )
A. 直线形 sp杂化 B. 三角形 sp2杂化
C. 三角锥型 sp2杂化 D. 三角锥型 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是( )
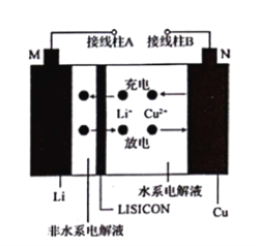
A. 陶瓷片允许水分子通过
B. 电池放电时,N极发生氧化反应
C. 电池充电时,阴极反应为Li++e-=Li
D. 电池充电时,接线柱B应与外接直流电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )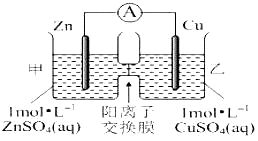
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的C(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关配合物的论述不合理的是
A.Na[Al(OH)4]和[Ag(NH3)2]OH都是配合物
B.Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6
C.[ZnCl4]2-的空间构型为正四面体形
D.配合物[Cr(H2O)4Br2]Br·2H2O中,中心离子的化合价为+3价,配离子带1个单位的正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaSO4是钡餐的主要成分,下列关于BaSO4的分类不正确的是
A.BaSO4是氧化物B.BaSO4是不溶物
C.BaSO4是钡盐D.BaSO4是硫酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
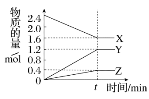
(1)该反应的化学方程式是________________________________________________。
(2)反应起始至t,Y的平均反应速率是____________。
(3)X的转化率是________。
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
(5)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有________ mol A,此时C的物质的量浓度为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com