
【题目】BaSO4是钡餐的主要成分,下列关于BaSO4的分类不正确的是
A.BaSO4是氧化物B.BaSO4是不溶物
C.BaSO4是钡盐D.BaSO4是硫酸盐
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于 ![]() 的说法正确的是( )
的说法正确的是( )
A.所有原子可能都在同一平面上
B.最多只可能有9个碳原子在同一平面
C.有7个碳原子可能在同一直线
D.只可能有5个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

①M极发生的电极反应式为___________________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑。下列说法错误的是( )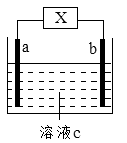
A.a、b不可能是同种材料的电极
B.X为电流计,c为稀盐酸,该装置为原电池
C.X为直流电源,c为稀硫酸,该装置为电解池
D.X为电流计,c为稀硫酸,a可能为铜电极,b可能为锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题: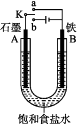
(1)若开始时开关K与a连接,则B极的电极反应为。
(2)若开始时开关K与b连接,则B极的电极反应为 , 总反应的离子方程式为。
(3)有关上述实验,下列说法正确的是。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。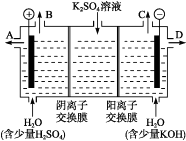
①该电解槽的阳极反应为。 此时通过阴离子交换膜的离子数(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组通过实验发现钾和钠的性质相似,下列说法中能最好地解释这个事实的是( )
A.都是金属元素
B.原子半径相差不大
C.最外层电子数相同
D.最高化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)已知有机物:
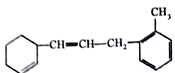
(1)该物质苯环上的一氯代物有_____种。
(2)1mol该物质和溴水混合,消耗Br2的物质的量为_____mol。
(3)1mol该物质和H2发生加成反应最多消耗H2______mol。
(4)下列说法不正确的是________(填序号)。
A.此物质可发生加聚、加成、取代、氧化等反应
B.1mol该物质中有2mol苯环
C.使溴水褪色的原理与乙烯相同
D.能使酸性KMnO4溶液褪色,发生的是加成反应
(Ⅱ)某有机物A化学式为CxHyOz,15gA完全燃烧可生成22gCO2和9gH2O。试求:
(5)该有机物的最简式________________。
(6)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为___________。
(7)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为____________。
(8)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,是人体生命活动的一种重要物质。则其结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2![]() 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图装置进行制取乙酸乙酯的实验。
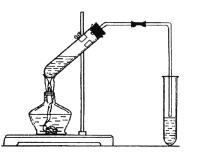
请回答下列问题:
(1)反应物中含有的官能团有____(填写名称)。
(2)实验室加入反应物和浓硫酸的先后顺序是____。
(3)浓硫酸在该反应中的作用是________。
(4)右边试管中的溶液是____,其作用是________。
(5)用同位素180示踪法确定反应原理(18O在CH3CH2OH中),写出能表示18O位置的化学方程式_______ ,反应类型是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com