
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑。下列说法错误的是( )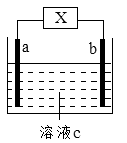
A.a、b不可能是同种材料的电极
B.X为电流计,c为稀盐酸,该装置为原电池
C.X为直流电源,c为稀硫酸,该装置为电解池
D.X为电流计,c为稀硫酸,a可能为铜电极,b可能为锌电极
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下可逆反应N2(g)+3H2(g) ![]() 2NH3(g),下列能够说明反应已经达到平衡状态的是
2NH3(g),下列能够说明反应已经达到平衡状态的是
A. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B. 氨气的百分含量不在变化
C. 断开一个N≡N键的同时有6个N—H键生成
D. 混合气体的质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据价层电子对互斥理论及原子的杂化轨道理论判断NF3分子的空间构型和中心原子的杂化方式为( )
A. 直线形 sp杂化 B. 三角形 sp2杂化
C. 三角锥型 sp2杂化 D. 三角锥型 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )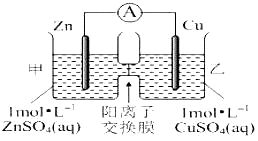
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的C(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关配合物的论述不合理的是
A.Na[Al(OH)4]和[Ag(NH3)2]OH都是配合物
B.Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6
C.[ZnCl4]2-的空间构型为正四面体形
D.配合物[Cr(H2O)4Br2]Br·2H2O中,中心离子的化合价为+3价,配离子带1个单位的正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6mol电子,则有1molCr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaSO4是钡餐的主要成分,下列关于BaSO4的分类不正确的是
A.BaSO4是氧化物B.BaSO4是不溶物
C.BaSO4是钡盐D.BaSO4是硫酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
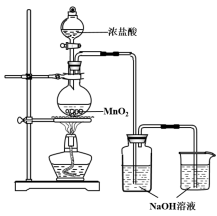
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
a. 测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
b. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(1)写出利用上述装置制备消毒液涉及反应的化学方程式 、 。
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有 性。
(3) 该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
① 操作b中溶液变成黄绿色的原因: (用离子方程式表示)。
② 有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是 。
(4) 有效氯的含量是检测含氯消毒剂消毒效果的重要指标。具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上。小组同学进行如下实验测定有效氯:取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加几滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-) 。注:相对原子质量Cl35.5,Na23,S32,O 16 ,I 127, K39
①达到滴定终点时的实验现象是 。
②此消毒液有效氯含量为 %(保留一位有效数字)。获得结论:此实验制得的消毒液 (填“符合”或“不符合”)家用要求。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com