
【题目】A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,设计成分分析方案如下,下列分析不正确的是( )
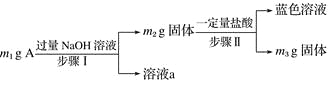
A. 当m1>m2时,溶液a中阴离子只有1种
B. 生成蓝色溶液的离子方程式涉Cu+2Fe3+===Cu2++2Fe2+
C. 要确定混合物中是否含Al,可取A加入适量稀HCl
D. 当m2-m3=2.96 g,Fe3O4的质量至少为2.32 g
【答案】A
【解析】试题分析:A、当m1>m2时,说明至少有Al2O3、Al两者中的一种,且生成了偏铝酸钠溶液,而过量的氢氧化钠,阴离子不至一种,故A错误;B、Fe3O4与盐酸反应生成氯化铁和氯化亚铁,三价铁离子有强氧化性,发生Cu+2Fe3+═Cu2++2Fe2+,故B正确;C、金属氧化物与酸反应生成水,无氢气,而铜与盐酸不反应在,可取A加入适量稀HCl,如果有气体产生,证明铝的存在,故C正确;D、因固体质量改变的金属氧化物的溶解,和三价铁与铜单质之间的氧化还原反应,Cu+2Fe3+=Cu2++2Fe2+,Fe3O4~2Fe3+~Cu,也就是四氧化三铁和铜的物质的量大于1:1,m2-m3=2.96g才符合,最小值为1:1,即2.96g×232÷(232+64)=2.32g,故D正确。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A. 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B. 配制100mL0.10molL﹣1NaCl溶液
配制100mL0.10molL﹣1NaCl溶液
C. 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D. 称量25gNaOH
称量25gNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法正确的是
A. 反应I、Ⅱ、Ⅲ、V均属于氧化还原反应
B. 甲、乙、丙和丁四种物质中都含有氮元素
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( ) 
A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是

A. Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O
B. bc段与cd段所消耗CO2的体积相同
C. bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32-
D. de段沉淀减少是由于BaCO3固体的消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1表示一些晶体中的某些结构,他们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子).
(1)其中代表金刚石的是(填编号字母,下同),金刚石中每个碳原子与个碳原子最接近且距离相等.
(2)其中代表石墨的是 , 其中每个正六边形占有的碳原子数平均为个;
(3)其中表示氯化钠的是 , 每个钠离子周围与它最接近且距离相等的钠离子有个;
(4)代表氯化铯的是 , 每个铯离子与个氯离子紧邻;
(5)代表干冰的是 , 每个二氧化碳分子与个二氧化碳分子紧邻;
(6)由Mg、C、Ni三种元素形成的一种具有超导性的晶体,晶胞如图2所示.Mg位于C和Ni原子紧密堆积所形成的空隙当中.与一个Ni原子距离最近的Ni原子的数目为 , 该晶体的化学式为 . 若该晶体的相对分子质量为M,阿伏加德罗常数为NA , Mg、C、Ni三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)气体制备时须先检查装置的气密性,下列各图所示装置,肯定不符合气密性检查要求的是 .
(Ⅱ)下面是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.分液漏斗 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填编号).
(2)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g.
(3)使用前要检查仪器是否漏液的是 (填编号).
(Ⅲ)实验室需要95mL 1.0molL﹣1稀硫酸,现用98%的浓硫酸(其密度为1.84g/mL)来进行配制.若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.250mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为 mL.
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
A.将稀释的硫酸液转移至容量瓶后,未洗涤烧杯和玻璃棒.
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外.
C.未冷却至室温就定容.
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切.
E.容量瓶使用时未干燥
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.钠和水反应:2Na+2H2O═2Na++2OH﹣+H2↑
B.碳酸钙与稀醋酸的反应:CO ![]() +2H+═CO2↑+H2O
+2H+═CO2↑+H2O
C.铜与稀硝酸的反应:Cu+2H+═Cu2++H2↑
D.常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+OH﹣═Cl﹣+ClO﹣+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA﹕AB=2﹕3, OA=AB, OA﹕AB=3﹕2,则下列分析与判断不正确的是(忽略CO2的溶解)( )

A. M中只有一种溶质的有(1)和(3)
B. M中有两种溶质的有(2)和(4)
C. (2)图显示M中的溶质为NaHCO3和Na2CO3,二者的物质的量之比为2:1
D. (4)图显示M中的溶质为NaOH和Na2CO3,二者的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com