
����Ŀ����ͼ1��ʾһЩ�����е�ijЩ�ṹ�����Ƿֱ����Ȼ��ơ��Ȼ�嵐��ɱ������ʯ��ʯī�ṹ�е�ijһ�ֵ�ijһ���֣��ڵ�ɱ�ʾ��ͬ����ͬ�����ӣ���
��1�����д������ʯ������������ĸ����ͬ�������ʯ��ÿ��̼ԭ������̼ԭ����ӽ��Ҿ�����ȣ�
��2�����д���ʯī���� �� ����ÿ����������ռ�е�̼ԭ����ƽ��Ϊ����
��3�����б�ʾ�Ȼ��Ƶ��� �� ÿ����������Χ������ӽ��Ҿ�����ȵ�������������
��4�������Ȼ�蘆��� �� ÿ����������������ӽ��ڣ�
��5�������ɱ����� �� ÿ��������̼��������������̼���ӽ��ڣ�
��6����Mg��C��Ni����Ԫ���γɵ�һ�־��г����Եľ��壬������ͼ2��ʾ��Mgλ��C��Niԭ�ӽ��ܶѻ����γɵĿ�϶���У���һ��Niԭ�Ӿ��������Niԭ�ӵ���ĿΪ �� �þ���Ļ�ѧʽΪ �� ���þ������Է�������ΪM�������ӵ�����ΪNA �� Mg��C��Ni����Ԫ�ص�ԭ�Ӱ뾶�ֱ�Ϊr1pm��r2pm��r3pm����þ�����ܶȱ���ʽΪgcm��3 ��
���𰸡�
��1��D��4
��2��E��2
��3��A��12
��4��C��8
��5��B��12
��6��8��MgNi3C��![]()
���������⣺��1���ڽ��ʯ�����У�ÿ��̼������Χ�ĸ�̼ԭ���γɹ��ۼ��������ĸ�̼ԭ����������������γ��������壬������һ��̼ԭ�ӣ�����ͼDΪ���ʯ��ÿ��̼ԭ�����ĸ�̼ԭ������Ҿ�����ȣ����ʯ�������ɹ��ۼ�����γɵĿռ���״�ṹ�ľ�������ԭ�Ӿ��壻���Դ��ǣ�D��4����2��ʯī�Dz�״�ṹ���ڲ����֮���Է��»�������ã��з��Ӿ�����ص㣬�ڲ���̼��̼�Թ��ۼ�����ã��γ������Σ�����ͼEΪʯī�Ľṹ��Ϊ��Ͼ��壬ÿ��̼ԭ�ӱ����������ι��ã�����ÿ����������ռ��̼ԭ����ƽ��Ϊ6�� ![]() =2�����Դ��ǣ�E��2����3����NaCl�����У�ÿ����������Χ�����������ӣ�ÿ����������ΧҲ�����������ӣ�����ͼAΪNaCl�Ľṹ�����ݾ����Ľṹ��ÿ����������Χ�����������������С���������Խ��ߵ�λ�ã�ÿ����������Χ�а˸������������壬�γ�12���棬������Խ����ϵ������Ӿ���12�������Դ��ǣ�A��12����4��CsCl�������Ӽ��γɵ����Ӿ��壬CsCl�ľ���������Ӻ������ӵ���λ������8����ÿ���������Χ��8�������ӣ�ÿ����������ΧҲ��8������ӣ�����ͼCΪCsCl�Ľṹ�����Դ��ǣ�C��8����5���ɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����ͼBΪ�ɱ����壬���Դ��ǣ�B��12����6������ͼ֪��ͬһ��������ÿ��Niԭ�Ӿ��������Niԭ����4�����ڿռ���ÿ��Niԭ�Ӿ��������Niԭ����8�����þ�����Mgԭ�Ӹ���=1��Cԭ�Ӹ���=8��
=2�����Դ��ǣ�E��2����3����NaCl�����У�ÿ����������Χ�����������ӣ�ÿ����������ΧҲ�����������ӣ�����ͼAΪNaCl�Ľṹ�����ݾ����Ľṹ��ÿ����������Χ�����������������С���������Խ��ߵ�λ�ã�ÿ����������Χ�а˸������������壬�γ�12���棬������Խ����ϵ������Ӿ���12�������Դ��ǣ�A��12����4��CsCl�������Ӽ��γɵ����Ӿ��壬CsCl�ľ���������Ӻ������ӵ���λ������8����ÿ���������Χ��8�������ӣ�ÿ����������ΧҲ��8������ӣ�����ͼCΪCsCl�Ľṹ�����Դ��ǣ�C��8����5���ɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����ͼBΪ�ɱ����壬���Դ��ǣ�B��12����6������ͼ֪��ͬһ��������ÿ��Niԭ�Ӿ��������Niԭ����4�����ڿռ���ÿ��Niԭ�Ӿ��������Niԭ����8�����þ�����Mgԭ�Ӹ���=1��Cԭ�Ӹ���=8�� ![]() =1��Niԭ�Ӹ���=6��
=1��Niԭ�Ӹ���=6�� ![]() =3�������仯ѧʽΪMgNi3C����������=
=3�������仯ѧʽΪMgNi3C����������= ![]() g���ϵ���Խ��߳���=��2r2+2r3��pm=��2r2+2r3����10��10cm���ʾ����ⳤ=
g���ϵ���Խ��߳���=��2r2+2r3��pm=��2r2+2r3����10��10cm���ʾ����ⳤ= ![]() ����2r2+2r3����10��10cm=
����2r2+2r3����10��10cm= ![]() ��r2+r3����10��10cm���������=[
��r2+r3����10��10cm���������=[ ![]() ��r2+r3����10��10cm]3=2
��r2+r3����10��10cm]3=2 ![]() ��r2+r3��3��10��30cm3 �� ���ܶ�=
��r2+r3��3��10��30cm3 �� ���ܶ�= ![]() =
= 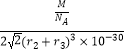 gcm��3=
gcm��3= ![]() gcm��3 �� ���Դ��ǣ�8��MgNi3C��
gcm��3 �� ���Դ��ǣ�8��MgNi3C�� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʳ�ð״����ɴ����봿ˮ���ƶ��ɣ����к͵ζ��ķ���ȷ�ⶨ���д�������ʵ���Ũ�ȣ�ʵ�鲽�裺������500mLŨ��ԼΪ0.1molL��1��NaOH��Һ������KHC8H4O4����Һȷ�ⶨ��NaOH��Һ��Ũ�ȣ�������֪ȷŨ�ȵ�NaOH��Һ�ⶨ�����Ũ�ȣ�
��1�����������NaOH�������ڴ��ձ��У�����500mL����ˮ�������ܽ⣮�����Ʋ���������С������С�����
��2������ʱNaOH�ڿ����м�����ˮ���������õ�NaOH��ҺŨ��ͨ����Ԥ�����С���������Dz���ֱ�����������Һ��ԭ��
��3�����İ״װ�װ˵�������Ậ��ԼΪ6g/100mL����������ʵ���Ũ��ԼΪmolL��1 �� �ζ�ǰ���״�ϡ�����10����100������������֪�������Է�������Ϊ60��
��4��ϡ�Ͱ״�ʱ��Ҫ���������ձ������������ιܡ���ʽ�ζ��ܡ� ��
��5��ȷ��ȡϡ�ͺ�İ״�20.00mL������250mL��ƿ�У���ˮ30mL���ٵμӷ�ָ̪ʾ����������NaOH����Һ�ζ�����Ϊ�յ㣮�ظ��ζ����Σ�ƽ������NaOH����ҺV mL��NaOH��ҺŨ��Ϊc molL��1����
��6��ԭ�״��д�������ʵ���Ũ��=molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݱ��������ķ���ʽ���й��ɣ��жϿո���������ͬ���칹����Ŀ���ǣ��������칹����������
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C5H12 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����Na2O2��NaHCO3��Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų����壬��ȴ���й�������ʣ�࣬����ѡ���ȷ���ǣ�������
Na2O2(mol) | NaHCO3(mol) | ����ɷ� | |
A | 1 | 2 | Na2CO3 |
B | 1.5 | 2 | Na2CO3��NaOH��Na2O2 |
C | 1 | 1 | Na2CO3��NaOH |
D | 2 | 1 | Na2CO3��NaOH��Na2O2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��Al2O3��Fe3O4��Al��Cu�е�ij���ַ�ĩ��϶��ɣ���Ƴɷַ����������£����з�������ȷ���ǣ� ��
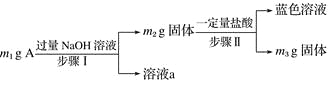
A. ��m1>m2ʱ����Һa��������ֻ��1��
B. ������ɫ��Һ�����ӷ���ʽ��Cu��2Fe3��===Cu2����2Fe2��
C. Ҫȷ����������Ƿ�Al����ȡA��������ϡHCl
D. ��m2��m3��2.96 g��Fe3O4����������Ϊ2.32 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
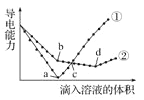
����Ŀ����������ͬ��Ba(OH)2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯����������ͼ��ʾ��
��ش��������⡣
(1)ͼ�Т١��ڷֱ�����μ�������Һ�ı仯����
��_____________����_____________��
(2)b�㣬��Һ�д������ڵ�������________________��
(3)���ߢ���d�㵼������������ԭ����____________(�û�ѧ����ʽ��ʾ)��
(4)c�㣬����Һ�к�����ͬ������������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��R��T��ԭ�Ӱ뾶��ԭ��������ϵ����ͼ��ʾ��Rԭ�������������ǵ��Ӳ�����2����Y��Z���γ�Z2Y��Z2Y2�����ӻ����Z��T�γɵĻ�����Z2T���ƻ�ˮ�ĵ���ƽ�⡣�����ƶ���ȷ���ǣ� ��
A.ԭ�Ӱ뾶�����Ӱ뾶�����㣺Y<Z
B.�⻯��ķе㲻һ���ǣ�Y>R
C.����������Ӧˮ��������ԣ�T<R
D.��X��R��Y��Z����Ԫ����ɵĻ�����ˮ��Һһ���Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ�������ж���ȷ���ǣ� ��
A. ���³�ѹ�£�18g2H2O���е�ԭ������ĿΪ3NA
B. ���³�ѹ�£�22.4 L O2�к��еķ�����ΪNA
C. 1mol Na��O2����ȫȼ��ת�Ƶĵ�����ĿΪNA
D. 1molL-1KHSO4��Һ�к��еļ�������ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʵ�����ע�ⰲȫ������˵����ȷ���ǣ� ��
A.ʵ���ҽ�����ͭ��Һֱ�Ӽ���������������ȡCuSO4��5H2O
B.���þƾ��ƶ�������ֱ�Ӽ���
C.�ñǿ״յ�������ȥ���������ζ
D.�����Ȼ�̼��ȡ��ı���Һ�е���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com