
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1molL﹣1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤(填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期(填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为molL﹣1 , 滴定前将白醋稀释(填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 .
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至即为终点.重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c molL﹣1).
(6)原白醋中醋酸的物质的量浓度=molL﹣1 .
【答案】
(1)可行
(2)小
(3)1;10
(4)100mL容量瓶
(5)溶液变成浅红色且30秒内不褪色
(6)![]()
【解析】解:(1)由于配制的是浓度约为0.1molL﹣1的NaOH溶液,是比较粗略的配制,故该配制步骤是可行的;故答案为:可行;(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,则配制出的溶液的浓度偏小;故答案为:小;(3)根据醋酸含量约为6g/100mL,则醋酸的物质的量n= ![]() =
= ![]() =0.1mol,醋酸的物质的量浓度c=
=0.1mol,醋酸的物质的量浓度c= ![]() =
= ![]() =1mol/L;酸碱中和滴定中待测液的浓度要为0.1mol/L左右,故滴定前要将醋酸溶液稀释10倍,故答案为:1;10;(4)稀释醋酸的操作为:用酸式滴定管量取一定体积的白醋,在烧杯中溶解,用玻璃棒引流注入100mL容量瓶,用胶头滴管定容,故需要的仪器有酸式滴定管、烧杯、玻璃棒、胶头滴管、100mL容量瓶,故答案为:100mL容量瓶;(5)由于是用碱滴定酸,指示剂是酚酞,故当溶液变成浅红色且30秒内不褪色时达到滴定终点;故答案为:溶液变成浅红色且30秒内不褪色;(6)设原白醋中醋酸的物质的量浓度为Xmol/L,根据达滴定终点时,n(CH3COOH)=n(NaOH),可有
=1mol/L;酸碱中和滴定中待测液的浓度要为0.1mol/L左右,故滴定前要将醋酸溶液稀释10倍,故答案为:1;10;(4)稀释醋酸的操作为:用酸式滴定管量取一定体积的白醋,在烧杯中溶解,用玻璃棒引流注入100mL容量瓶,用胶头滴管定容,故需要的仪器有酸式滴定管、烧杯、玻璃棒、胶头滴管、100mL容量瓶,故答案为:100mL容量瓶;(5)由于是用碱滴定酸,指示剂是酚酞,故当溶液变成浅红色且30秒内不褪色时达到滴定终点;故答案为:溶液变成浅红色且30秒内不褪色;(6)设原白醋中醋酸的物质的量浓度为Xmol/L,根据达滴定终点时,n(CH3COOH)=n(NaOH),可有 ![]() ×0.02L=c molL﹣1×Vml×10﹣3 , 解得x=
×0.02L=c molL﹣1×Vml×10﹣3 , 解得x= ![]() mol/L;故答案为:
mol/L;故答案为: ![]() . (1)根据配制NaOH溶液是比较粗略的配制来判断;(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小来分析浓度;(3)根据醋酸含量约为6g/100mL,计算出醋酸的物质的量,然后根据c=
. (1)根据配制NaOH溶液是比较粗略的配制来判断;(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小来分析浓度;(3)根据醋酸含量约为6g/100mL,计算出醋酸的物质的量,然后根据c= ![]() 来计算;酸碱中和滴定中待测液的浓度要为0.1mol/L左右;(4)根据稀释醋酸的操作来分析需要的仪器;(5)根据加入的指示剂是酚酞来分析滴定终点;(6)根据达滴定终点时,n(CH3COOH)=n(NaOH)来计算.
来计算;酸碱中和滴定中待测液的浓度要为0.1mol/L左右;(4)根据稀释醋酸的操作来分析需要的仪器;(5)根据加入的指示剂是酚酞来分析滴定终点;(6)根据达滴定终点时,n(CH3COOH)=n(NaOH)来计算.


科目:高中化学 来源: 题型:
【题目】1mol/LNaOH溶液的含义是( )
A.1L溶液中含有40gNaOHB.1L水中含有1molNaOH
C.溶液中含有1molNaOHD.将40gNaOH溶于1L水中所得的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g)2NH3(g)△H=QkJmol﹣1 . 反应过程中能量变化如图所示,回答下列问题: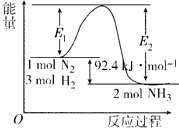
(1)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2 , 充分反应后,放出的热量(填“<”“>”或“=”)46.2kJ,理由是 .
(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol.则该条件下达到平衡时H2的转化率为 . 该温度下的平衡常数K的值为 . 若升高温度,K值(填“增大”“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有CuSO4、NaCl、KNO3各1mol的溶液分别置于甲、乙、丙三个烧杯中进行电解(电极均为石墨且质量相等),如图1所示.接通电源一段时间后,b电极质量增加;常温下,三个烧杯中溶液的pH随通电时间的变化如图2.
(1)M是直流电源的极;(填“正”或“负”)
(2)乙烧杯内若滴入酚酞试液,则在极区域先出现红色;(填“c”或“d”)
(3)0~t1秒内,e电极上生成的气体在标准状况下的体积为L,t1秒时,电极b、c的质量差为g;
(4)t2秒时,若将直流电源正、负极对调,则电解至各电极质量均不再发生变化的过程中,a电极涉及到的电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A. 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B. 配制100mL0.10molL﹣1NaCl溶液
配制100mL0.10molL﹣1NaCl溶液
C. 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D. 称量25gNaOH
称量25gNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 将硫酸钾、硫酸铝、硫酸钾铝三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L,c(Al3+)=0.055mol/L,c(H+)=0.01mol/L,则c(K+)为( )
A.0.045 mol/LB.0.035 mol/LC.0.055 mol/LD.0.040 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.盐酸:HCl→H++Cl﹣
B.硫酸:H2SO4→H2++SO42﹣
C.硫酸铝:Al2(SO4)3→Al23++(SO4)32﹣
D.氢氧化钠:NaOH→Na++H++O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能含有K+、Mg2+、Al3+、AlO2—、SiO32—、SO32—、CO32—、SO42—中的若干种离子。某同学对该溶液X进行了如下实验;下列判断正确的是( )
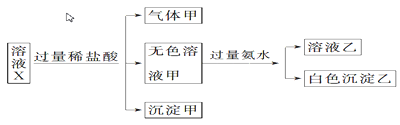
A. 气体甲一定是纯净物
B. K+、AlO2—和SiO32—一定存在于溶液X中
C. 沉淀甲是硅酸和硅酸镁的混合物
D. 凭以上实验能确定SO42—是否存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1表示一些晶体中的某些结构,他们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分(黑点可表示不同或相同的粒子).
(1)其中代表金刚石的是(填编号字母,下同),金刚石中每个碳原子与个碳原子最接近且距离相等.
(2)其中代表石墨的是 , 其中每个正六边形占有的碳原子数平均为个;
(3)其中表示氯化钠的是 , 每个钠离子周围与它最接近且距离相等的钠离子有个;
(4)代表氯化铯的是 , 每个铯离子与个氯离子紧邻;
(5)代表干冰的是 , 每个二氧化碳分子与个二氧化碳分子紧邻;
(6)由Mg、C、Ni三种元素形成的一种具有超导性的晶体,晶胞如图2所示.Mg位于C和Ni原子紧密堆积所形成的空隙当中.与一个Ni原子距离最近的Ni原子的数目为 , 该晶体的化学式为 . 若该晶体的相对分子质量为M,阿伏加德罗常数为NA , Mg、C、Ni三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为gcm﹣3 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com