
����Ŀ��������CuSO4��NaCl��KNO3��1mol����Һ�ֱ����ڼס��ҡ��������ձ��н��е�⣨�缫��Ϊʯī��������ȣ�����ͼ1��ʾ����ͨ��Դһ��ʱ���b�缫�������ӣ������£������ձ�����Һ��pH��ͨ��ʱ��ı仯��ͼ2��
��1��M��ֱ����Դ�������������������
��2�����ձ����������̪��Һ�������������ȳ��ֺ�ɫ�����c����d����
��3��0��t1���ڣ�e�缫�����ɵ������ڱ�״���µ����ΪL��t1��ʱ���缫b��c��������Ϊg��
��4��t2��ʱ������ֱ����Դ���������Ե������������缫���������ٷ����仯�Ĺ����У�a�缫�漰���ĵ缫��ӦʽΪ �� 
���𰸡�
��1����
��2��d
��3��5.6��32
��4��2H++2e��=H2����Cu2++2e��=Cu
���������⣺��ͨ��Դһ��ʱ���b�缫�������ӣ�Ӧ������������bΪ������aΪ��������֪MΪ������NΪ������c��eΪ������d��f��������1��M��ֱ����Դ�����������Դ��ǣ�������2��cΪ����������������Ӧ����������d�������������ӵõ��Ӳ����������õ缫��������������Ũ�����ӣ���ʾ���ԣ�������̪��ʾ��ɫ�����Դ��ǣ�d����3����ͼ2��֪t1sʱ����1molCl����ȫ�ŵ磬ת��1mol���ӣ�e�缫�����ɵ�����Ϊ����������4OH����4e��=2H2O+O2�����������������ʵ���Ϊ0.25mol�����Ϊ0.25mol��22.4L/mol=5.6L��b�缫����Cu2++2e��=Cu������0.5molCu������Ϊ0.5mol��64g/mol=32g����缫b��c��������Ϊ32g�����Դ��ǣ�5.6��32����4��t2sʱ������ֱ����Դ���������˶Ե����������ҺΪ���ᣬaΪ��������������������Ȼ������ͭ���缫����ʽΪ��2H++2e��=H2����Cu2++2e��=Cu�����Դ��ǣ�2H++2e��=H2����Cu2++2e��=Cu��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.1mol/Lϡ�����ˮϡ�ͣ���ͼ�е�������y�����ǣ� �� 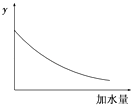
A.��Һ��pH
B.����ĵ���ƽ�ⳣ��
C.��Һ�ĵ�������
D.����ĵ���̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ô���ͱ��������Ӵ��·�Ӧ��ȡ�屽���õ����屽��Ҫ�����²������ƣ���ȷ�IJ���˳���ǣ� �� ������ ��ˮϴ��Һ ���ø�������� ��10%NaOH��Һϴ��Һ
A.�٢ڢۢܢ�
B.�ڢܢڢۢ�
C.�ܢڢۢ٢�
D.�ڢܢ٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʱ����˵����ȷ�������(����)
����Ӧ���ܷ���ú���б���
�ڹ������ƿ���¶���ڿ����б���
����ˮӦ���ܷ�����ɫ�Լ�ƿ�б���
������������Һ����¶���ڿ����б���
A.�٢�B.�٢ڢۢ�
C.�٢ۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ����������Ĺ������£�
��1���Ե���������Ϊԭ�Ϻϳɰ������д�ʩ�������H2��ת�����ǣ���ѡ����ţ� ��
a��ѡ���ʵ��Ĵ��� b������ѹǿ c����ʱ�������ɵ�NH3d�������¶�
��һ���¶��£����ܱ������г���1molN2��3molH2������Ӧ���������ݻ��㶨���ﵽƽ��״̬ʱ�������ڵ�ѹǿ��ԭ���� ![]() ����N2��ת����a1=��
����N2��ת����a1=��
������ѹǿ�㶨���ﵽƽ��״̬ʱ��N2��ת����Ϊa2 �� ��a2a1�����������������=����
��2������������Ϊ��Ҫԭ�������ᣮ���ݻ��㶨���ܱ������н��з�Ӧ2NO��g��+O2��g��2NO2��g����H��0
�÷�Ӧ�ķ�Ӧ���ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ����ͼ��ʾ����t2��t4ʱ��ֻ�ı�һ������������˵����ȷ���ǣ���ѡ����ţ� �� 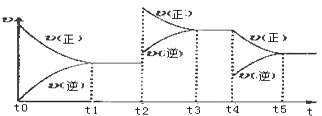
a����t1��t2ʱ�������������������ѹǿ���ֲ����жϷ�Ӧ�Ѵﵽƽ��״̬
b����t2ʱ����ȡ�Ĵ�ʩһ���������¶�
c����t3��t4ʱ��������������������ܶȱ��ֲ����жϷ�Ӧ�Ѵﵽƽ��״̬
d����t0��t5ʱ��������NO2�����������t3ʱֵ�����
��3�����᳧��������2�ַ�������β�����ٴ���ԭ������������ʱ��H2��NO2��ԭΪN2 ��
��֪��2H2��g��+O2��g��=2H2O��g����H=��483.6kJ/mol
N2��g��+2O2��g��=2NO2��g����H=+67.7kJ/mol
��H2��ԭNO2����ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
�ڼ�Һ���շ�����Na2CO3��Һ����NO2����CO2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ���������ӷ���ʽBa2++SO42-��BaSO4����ʾ���� (����)
A. Ba(NO3)2+H2SO4��BaSO4��+2HNO3 B. BaCl2+Na2SO4��BaSO4��+2NaCl
C. BaCl2+H2SO4��BaSO4��+2HCl D. BaCO3+H2SO4��BaSO4��+H2O+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�����ֳ����Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ��ʾ��
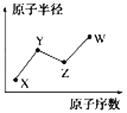
��֪Y��Z����Ԫ�صĵ����ǿ�������Ҫ�ɷ֣�Wԭ�ӵ�������������Neԭ�ӵ��������������1����ش��������⣺
��1��д������Ԫ�ص�Ԫ�ط��ţ�W________��X________��Y________��Z________��
��2������Ԫ�ص����л��ϼ��У�������ϼ�Ϊ________�ۣ���������ϼ�Ϊ________�ۡ�
��3�����ҷֱ�����W��X��Y��Z����Ԫ���е�����Ԫ����ɵij���������������������ɱ�����ã��仯ѧʽΪ________������������һ�ֳ����Ļ��ʣ��仯ѧʽΪ________��
��4��HYO3�����Ա�HWOǿ�����˾ݴ���ΪY�ķǽ�����ǿ��W������Ϊ���ֿ����Ƿ���ȷ��˵�����ɣ�________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ͼʵ��װ�õ�˵����ȷ����( )
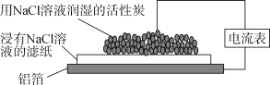
A����װ�õ�������û�е���ͨ��
B������������
C���ܷ�ӦΪ4Al��3O2��6H2O===4Al(OH)3
D�����Ӵ�������������������������̿����ֽ�ص�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ������������������B�ĵ����ڳ�����Ϊ˫ԭ�ӷ��ӣ�����A�ĵ��ʿ��γ���̬����X��X��ˮ��Һ�ʼ��ԣ�D�ļ���������X������ͬ�ĵ���������D��ͬ����Ԫ����ԭ�Ӱ뾶����Ԫ�أ�EԪ�ص�ԭ�������ȴ�������������ӣ�C��F����Ԫ�ص�ԭ������㹲��13�����ӡ���
(1)X�ĵ���ʽΪ___________��
(2)B���ʵĽṹʽΪ___________���õ���ʽ��ʾE����̬�⻯����γɹ��̣�___________________________��
(3)C��D�γɵ����ֻ������У�����һ�����ʺ����������͵Ļ�ѧ��������������________(����ӻ�������ۻ����)��
(4)B��C��E�ֱ���A�γɵĻ����������ȶ�����______(д�ṹʽ)��
(5)D��ͬ���ڼ������������Ӱ뾶��____��Ԫ�ء�
(6)F�ĵ����ڷ�Ӧ�г���________��(���������ԭ��)��F�ĵ�����ˮ��Ӧ�����ӷ���ʽ___________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com