
【题目】25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( ) 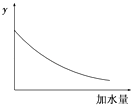
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液的导电能力
D.醋酸的电离程度
【答案】C
【解析】解:A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,故A错误;B.温度不变,醋酸的电离平衡常数不变,故B错误;
C.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故C正确;
D.加水稀释促进醋酸电离,则醋酸的电离程度增大,故D错误;
故选C.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.非极性分子只能是双原子单质分子
B.键能越大,表示该分子越容易受热分解
C.液态氟化氢中氟化氢分子之间存在氢键
D.分子中中心原子通过 sp3 杂化轨道成键时,该分子一定为正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中,有A.B两种气体,反应按下式进行A(g)+B(g)═2C(g)反应经过2S后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L.
(1)B物质的起始浓度为
(2)2S时A的转化率
(3)用物质A表示反应的平均速率 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
选项 | 含杂质的物质 | 试剂 | 除杂方法 |
A | C2H4(SO2) | NaOH溶液 | 洗气 |
B | C6H6(苯酚) | 浓Br2水 | 过滤 |
C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
D | C2H2(H2S) | CuSO4溶液 | 洗气 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( ) 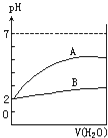
A.酸B比酸A的电离度大
B.A为弱酸,B为强酸
C.酸B的物质的量浓度比A的小
D.A酸比B酸易电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是
A. a与其他三种元素形成的元化合物中其化合价均为+1
B. b与其他三种元素均可形成至少两种二元化合物
C. d和a形成的化合物的溶液呈弱酸性
D. C的原子半径是这些元素中最大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,纯水中的c(H+)=2.0×10﹣7mol/L,此时溶液的c(OH﹣)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10﹣4mol/L,则溶液中,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有CuSO4、NaCl、KNO3各1mol的溶液分别置于甲、乙、丙三个烧杯中进行电解(电极均为石墨且质量相等),如图1所示.接通电源一段时间后,b电极质量增加;常温下,三个烧杯中溶液的pH随通电时间的变化如图2.
(1)M是直流电源的极;(填“正”或“负”)
(2)乙烧杯内若滴入酚酞试液,则在极区域先出现红色;(填“c”或“d”)
(3)0~t1秒内,e电极上生成的气体在标准状况下的体积为L,t1秒时,电极b、c的质量差为g;
(4)t2秒时,若将直流电源正、负极对调,则电解至各电极质量均不再发生变化的过程中,a电极涉及到的电极反应式为 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com