
【题目】下列说法中正确的是
A.非极性分子只能是双原子单质分子
B.键能越大,表示该分子越容易受热分解
C.液态氟化氢中氟化氢分子之间存在氢键
D.分子中中心原子通过 sp3 杂化轨道成键时,该分子一定为正四面体结构
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( ) 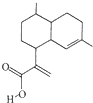
A.分子式为C15H24O2
B.属子芳香族化合物
C.能发生取代反应和加成反应
D.分子中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________(填名称),可以验证该结论的实验是_______。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________(用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=﹣105kJmol﹣1 . 向体积为2L的密闭容器中充入2molCO和4molH2 , 测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示: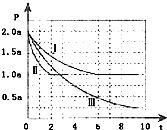
(1)Ⅱ和Ⅰ相比,改变的反应条件是 .
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= .
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)= .
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1T3(填“>”“<”“=”),判断的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
(1)下列四种化合物中含铜量最高的是(填字母)
A.Cu5FeS4
B.CuFeS2
C.Cu2S
D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为万吨.(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂﹣﹣肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).①该制备过程的反应方程式为 .
②工业上常用的固液分离设备有(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图: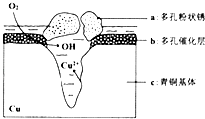
①腐蚀过程中,负极是(填“a”“b”或“c”),正极反应方程式为 .
②环境中的Cl﹣扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中P点代表氢元素。下列说法不正确的是( )
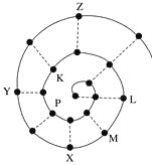
A. 图中虚线相连的元素位于同一族
B. P、K、L、M、X、Y、Z都是短周期元素
C. K元素位于常规周期表的第三周期第ⅥA族
D. M与Z 两种元素形成的化合物的化学式为MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列提纯物质方法正确的是( )
A.用BaCl2溶液除去HNO3溶液中的少量H2SO4
B.用NaOH溶液除去铝粉中的少量铁粉
C.用氯水除去FeCl2溶液中的少量FeCl3
D.用加热法除去NaCl固体中的少量NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 . CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为
利用反应6NO2+8NH3 ![]() 7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
(2)已知:2SO2(g)+O2(g)![]()
![]() 2SO3(g)△H=﹣196.6kJmol﹣1
2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
则反应SO2(g)+NO2(g)=SO3(g)+NO(g)的△H=kJmol﹣1
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H0(填“>”或“<”)实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 . 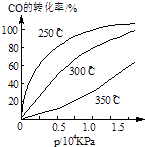
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( ) 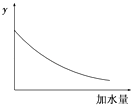
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液的导电能力
D.醋酸的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com