
【题目】A、B、C、D、E五种元素位于元素周期表的前四周期,其核电荷数依次增大。A的阴离子与He具有相同的电子层结构,B原子的核外有三对自旋方向相反的电子,C原子的核外有两个未成对电子,D与B同主族,E原子与A原子的最外层电子数相同,且内层充满电子。
(1)A原子的电子所处的原子轨道的形状为_______。
(2)B原子的核外电子排布式为_______, B元素位于元素周期表的_______区。
(3)M是由B、D原子组成的一种具有漂白性的分子,M分子的空间构型为_______,N是由B、D原子构成的一种阴离子,D呈现最高价,则D原子的杂化方式为_______。写出一种N的等电子体的化学式_______。
(4)B与C形成的一种无限长单链结构如下图所示,该结构中B与C的原子数之比为_______。

(5)E位于元素周期表第_______族。已知单质E的晶体为面心立方最密堆积,E的原子半径为anm,其晶胞的平面切面图如右图所示。列式表示E晶胞中原子的空间利用率_______(空间利用率等于晶胞中原子的体积占晶胞体积的百分比。注意:只写数值不得分)。

【答案】 球形 1s22s22p4 p V形或折线形 sp3 ClO4-、PO43-、CCl4等 3:1 IB 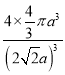
【解析】A、B、C、D、E五种元素位于元素周期表的前四周期,其核电荷数依次增大。A的阴离子与He具有相同的电子层结构,则A为氢元素;B原子的核外有三对自旋方向相反的电子,则B为氧元素,D与B同主族,则D为硫元素;C原子的核外有两个未成对电子,则C为硅元素;E原子与A原子的最外层电子数相同,且内层充满电子,则E的核电荷数为29,E为铜元素;
(1)A原子的电子所处的原子轨道为1s,其形状为球形;
(2)基态氧原子的核外电子排布式为1s22s22p4, B元素位于元素周期表的第二周期ⅥA族,属于p区元素;
(3)由O、S原子组成的一种具有漂白性的分子是SO2,SO2分子的中心原子S原子的杂化轨道数为![]() =3,采取sp2杂化,含有1对孤对电子对,故SO2为V型结构;S的最高价为+6价,则N是SO42-,SO42-中S形成4个σ键,孤对电子数为
=3,采取sp2杂化,含有1对孤对电子对,故SO2为V型结构;S的最高价为+6价,则N是SO42-,SO42-中S形成4个σ键,孤对电子数为![]() =0,为sp3杂化;与SO42-等电子体的微粒有ClO4-、PO43-、CCl4等;
=0,为sp3杂化;与SO42-等电子体的微粒有ClO4-、PO43-、CCl4等;
(4)O与Si形成的一种无限长单链结构如下图所示,氧原子数为2+2×![]() =3、Si原子数为1,则该结构中B与C的原子数之比为3:1;
=3、Si原子数为1,则该结构中B与C的原子数之比为3:1;
(5)Cu元素核电荷数为29,其位于元素周期表第四周期第IB族。Cu的原子半径为anm,晶胞的边长为2 ![]() nm,Cu原子的体积为
nm,Cu原子的体积为![]() ,晶胞的体积为(2
,晶胞的体积为(2 ![]() nm)3;晶胞中含有Cu原子数为8×
nm)3;晶胞中含有Cu原子数为8×![]() +6×
+6×![]() =4,则Cu晶胞中原子的空间利用率为
=4,则Cu晶胞中原子的空间利用率为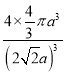 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
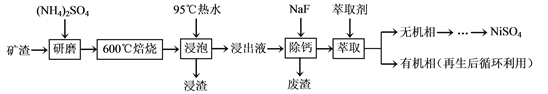
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
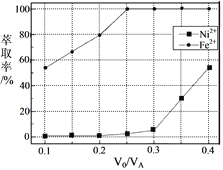
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。

【实验探究】
(1)实验室制取氨气应选用下图中________发生装置进行实验,反应的化学方程式为
_________________________

(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是____________________________________________________________。
(5)F装置中倒置漏斗的作用________________________________________________。
(6)某同学用右图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3 + 6NO2 ==7N2 + 12H2O
该反应中氨气体现________(填“氧化性”或“还原性”)。请你列举出氨气的另一种用途_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备肥皂的过程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答:
(1)加入乙醇的目的是__________________________________________。
(2)证明油脂完全反应的方法是_____________________________________________________。
(3)以硬脂酸甘油酯为例,写出皂化反应的方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 和泥沙,可将粗盐溶于水,然后进行下列五项操作:
和泥沙,可将粗盐溶于水,然后进行下列五项操作:
①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
通过教材中“粗盐的提纯”及你做过的该实验回答下列问题:
(1)以上五步操作中,最后进行的是________。
(2)实验室进行NaCl溶液的蒸发时,一般有以下操作过程:
①固定铁圈位置 ②放置酒精灯 ③放上蒸发皿(蒸发皿中盛有NaCl溶液) ④加热搅拌
⑤停止加热
正确的操作顺序为________。
(3)在粗盐经过一系列操作后的溶液中滴加过量饱和Na2CO3溶液。请问这步操作的目的是______________________。判断Na2CO3溶液已经过量的方法是__________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:______________________________________________________________。
过滤时:______________________________________________________________。
蒸发时:______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有机物在化学反应中断键的位置,可以准确分析产物结构并判断反应类型。有机物A中只含有C、H、O三种元素,它的球棍模型如下:

(1)A的分子式为_______,写出碳原子数比A少的A的一种同系物的结构简式____。
(2)工业中采取烯烃水化法制取A,该烯烃的结构简式为_______。
(3)A与乙酸、浓硫酸共热反应,断裂的化学键为_______(填序号,下同),该反应的有机产物中官能团的名称为_______。
(4)在Cu催化和加热条件下,A与O2反应断裂①、③两处共价键,写出该反应的化学方程式_______。
(5)A与亚硫酞氯(SOCl2)在一定条件下反应生成一种一氯代烃,A 断裂的共价键为_______,该反应类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:


(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)。[来
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
(3)某温度下Ksp[ Mg(OH)2] = 2×10 -11,若该温度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的叙述正确的是 ( )。
A. 胶体带电荷,而溶液呈电中性
B. 胶体中加入电解质可产生沉淀,而溶液不能
C. 胶体是一种不稳定的分散系,而溶液是一种非常稳定的分散系
D. 胶体能够发生丁达尔效应,而溶液则不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:Ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ热量。
Ⅱ.
判断下列说法正确的是( )
A. 反应A的ΔH>-115.6 kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由Ⅱ中的数据判断氯元素的非金属性比氧元素强
D. 断开1 mol H—O键与断开1 mol H—Cl键所需能量相差31.9 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com