
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子占有的原子轨道数为______个,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PCl3分子中的中心原子杂化轨道类型是______,该分子构型为_______。
(3)PH4Cl的电子式为______,Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为________。
⑷己知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 Pm和 69 pm,则熔点:MgO___NiO(填“>”、“<”或“=”),理由是______。
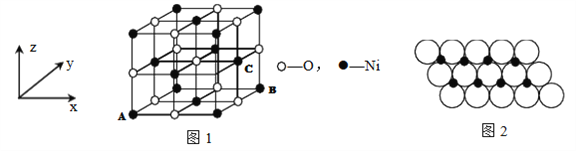
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Mi2+填充其中(如图2),己知O2-的半径为a m,每平方米面积上分散的该晶体的质量为____g。(用a、NA表示)
【答案】 9 Cl> P > S sp3 三角锥形 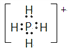
![]() 1∶1 > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2)
1∶1 > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2) ![]() 或
或![]()
【解析】(1)基态 Cl原子电子排布为1s22s22p63s23p7,此时其核外电子占有的原子轨道数为9,同周期随原子序数增大,元素第一电离能呈增大强酸,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Cl>P>S,故答案为:9;Cl>P>S;
(2)PCl3中P原子杂化轨道数为![]() (5+3)=4,采取 sp3杂化方式,1对孤对电子对,所以该分子构型为三角锥形,故答案为:sp3;三角锥形;
(5+3)=4,采取 sp3杂化方式,1对孤对电子对,所以该分子构型为三角锥形,故答案为:sp3;三角锥形;
(3)PH4Cl的电子式为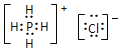 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键为:1×4+4=8与π键个数为:2×4=8,所以个数之比为1:1,故答案为:
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键为:1×4+4=8与π键个数为:2×4=8,所以个数之比为1:1,故答案为: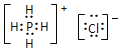 ;1:1;
;1:1;
(4)Mg2+半径比Ni2+小,所以氧化镁的晶格能大于氧化镍,则熔点:MgO>NiO,故答案为:>;Mg2+半径比Ni2+小,MgO的晶格能比NiO大;
(5)NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),而C离子的x系坐标与Bx系坐标相同,y、z系坐标都在中点上,所以C离子坐标参数为(1,1/2,1/2),故答案为:(1,1/2,1/2);
(6)根据图片知,每个氧化镍所占的面积=(2×am)×(2×am×sin60°)=2![]() a2m2,则每平方米含有的氧化镍个数=
a2m2,则每平方米含有的氧化镍个数=![]() ,每个氧化镍的质量=
,每个氧化镍的质量=![]() g,所以每平方米含有的氧化镍质量=
g,所以每平方米含有的氧化镍质量=![]() ×
×![]() g=
g=![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是

A. 该电池工作时将电能转化为化学能
B. 通常一段时间后该电池只需更换铝板就可继续使用
C. 负极反应式是:O2 + 2H2O+ 4e- = 4OH-
D. 铝片发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境、健康及能源的叙述中,不正确的是
A. 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含 量是空气质量报告的主要项目
B. PM2.5表面积大,能吸附大量的有毒有害的物质,对人的肺功能造成很大伤害
C. 聚乙烯是生产食品保鲜膜、塑料水杯等生活用品的主要材料,不能用聚氯乙烯替代
D. 利用催化转化装置可以将汽车尾气中的NOx、CO等有害气体转化为N2、CO2等无害气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污 水工艺的流程如下:

(1)请写出N2H4的电子式____________________。
(2)下列溶液中,可以代替上述流程中N2H4的是______________(填选项序号)。
A. FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为________________。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为_______________________________。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为___________________________。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①己知含铬废水中存在着平衡,Cr2O72-和CrO42-在溶液中可相互转化,请用离子方程式表示它们之间的转化反应____________________________。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx,挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H=+67.0 kJ·mol-1
2NO2(g)△H=+67.0 kJ·mol-1
③H2O(g)=H2O(l)△H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
CO2(g)+2H2O(g)+N2(g)△H=_____kJ·mol-1;
(2)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
① a表示_____离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品。其中C为硫酸,则A表示_______。
②阳极的电极反应式为____________________。
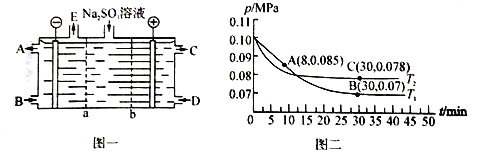
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率v0(正)与A点的逆反应速率vA(逆)的大小关系为v0(正)_____vA(逆) (填“>"、“<”或“ = ”)。
③图中B点的压强平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯的说法正确的是( )
A.是天然气的主要成分
B.不能使稀的酸性高锰酸钾溶液褪色
C.是一种植物生长调节剂
D.是聚乙烯塑料袋的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A. 铝片和稀硫酸反应
B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应
D. 甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
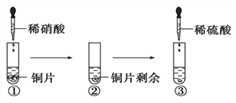
下列说法正确的是
A. ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B. ②中溶液存在:c(Cu2+) + c(H+) = c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4 === 4CuSO4 +2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图装置(Ⅰ)为以NaOH溶液为电解质溶液的氢氧燃料电池。装置(Ⅰ)中a和b为气体进口,其中a口进入的是(填名称)____________, 写出电极②发生反应的电极反应式_______________
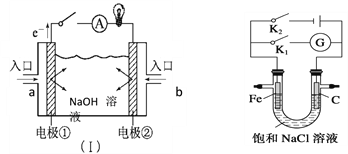
(2)如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,并在溶液中滴加酚酞
①若闭合K1,铁棒上的电极反应为__________________________
②若闭合K2,铁棒附近观察到的现象是_______________________写出石墨棒上发生的电极反应式____________________________电路中通过0.02 NA个电子时,两极共产生_______ mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com