
ij��Ԫ��(��ѧʽ��H2A��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2A===H����HA��HA�� H����A2���ش��������⣺
H����A2���ش��������⣺
(1)Na2A��Һ��____(����ԡ��������ԡ����ԡ�)�������ǣ�______(�����ӷ���ʽ���Ҫ������˵��)��
(2)�����£���֪0.1 mol��L��1 NaHA��ҺpH��2����0.1 mol��L��1 H2A��Һ�������ӵ����ʵ���Ũ�ȿ���_______0.11 mol��L��1(����ڡ��������ڡ���С�ڡ�)��������______��
(3)0.1 mol��L��1 NaHA��Һ�и�������Ũ���ɴ�С��˳����_______ ___��
(1)�Na2A��A2��ˮ��ʹ��Һ��c(OH��)>c(H��)��A2����H2O HA����OH��
HA����OH��
(2)<��H2A��һ�������c(H��)��0.1 mol��L��1�Ҷ�HA���ĵ������������ã�ʹH2A�ڶ����������c(H��)<0.01 mol��L��1 (3)c(Na��)��c(HA��)��c(H��)��c(A2��)��c(OH��)
��������
�����������1������H2A�ĵ����֪��H2A�ĵ�һ����������ȫ�ģ����ڶ��������Dz���ȫ�ģ�����Na2A����ˮ��A2��ˮ�⣬��Һ�Լ��ԣ�ˮ��ԭ���ǣ�H2O+A2�� HA��+OH����
HA��+OH����
��2��0.1mol/L��H2A��Һ�е�һ���������������Ũ����0.1mol/L�����ڵ�һ��������������ӻ�����HA���ĵ��룬������Һ�������ӵ����ʵ���Ũ��С��0.11mol/L��
��3��HA������Һ��ֻ�е���ƽ�⣬��Һ�����ԣ�����Һ�и�������Ũ���ɴ�С��˳����c(Na��)��c(HA��)��c(H��)��c(A2��)��c(OH��)��
���㣺����������ʵĵ��롢����ˮ�⡢��Һ����Ե��ж��Լ���Һ������Ũ�ȵĴ�С�Ƚ�
�������������е��Ѷȵ����⣬���������߿������۽̲Ļ���֪ʶ��ּ������ѧ��������û���֪ʶ���ʵ�����������������������������ѧ���������������ʹ���˼ά����������Ĺؼ���ע��H2A�ĵ����ص㣬Ȼ��������������ü��ɡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(��)�����£���ijһԪ��HA(�ס��ҡ�������������ͬ��һԪ��)��NaOH��Һ�������ϣ�������Һ�����ʵ���Ũ�Ⱥͻ����Һ��pH���±���ʾ��
| ʵ���� | HA�����ʵ��� Ũ��(mol��L-1) | NaOH�����ʵ��� Ũ��(mol��L-1) | ��Ϻ� ��Һ��pH |
| �� | 0.1 | 0.1 | pH=a |
| �� | 0.12 | 0.1 | pH=7 |
| �� | 0.2 | 0.1 | pH>7 |
| �� | 0.1 | 0.1 | pH=10 |
(1)�Ӽ����������������ж�HA��ǿ�ỹ������? �� ��
(2)��������Һ������Ũ��c(A�� )��c(Na+)�Ĵ�С��ϵ�� �� ��
A��ǰ�ߴ� B. ���ߴ� C. ������� D�����ж�
(3)�ӱ���ʵ�����������û����Һ������Ũ���ɴ�С��˳���� �� ��
(4)��������ʵ�����ݣ�д���û����Һ��������ʽ�ľ�ȷ���(��ʽ)��
c(Na+)��c(A-)= �� mol��L-1
(��)ij��Ԫ��(��ѧʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�
![]()
![]()
�ش��������⣺
(5)��0��1mol��L��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ���� �� ��
A.c( B2�� )+c(HB�� )=0��1mol��L B��c( B2�� )+ c(HB�� )+c(H2B)=0��1mol��L
C c(OH�� )=c(H+)+ c(HB�� ) D��c(Na+)+c(OH)=c(H+)+ c(HB�� )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(��)�����£���ijһԪ��HA(�ס��ҡ�������������ͬ��һԪ��)��NaOH��Һ�������ϣ�������Һ�����ʵ���Ũ�Ⱥͻ����Һ��pH���±���ʾ��
| ʵ���� | HA�����ʵ��� Ũ��(mol��L-1) | NaOH�����ʵ��� Ũ��(mol��L-1) | ��Ϻ� ��Һ��pH |
| �� | 0.1 | 0.1 | pH=a |
| �� | 0.12 | 0.1 | pH=7 |
| �� | 0.2 | 0.1 | pH>7 |
| �� | 0.1 | 0.1 | pH=10 |
(1)�Ӽ����������������ж�HA��ǿ�ỹ������? �� ��
(2)��������Һ������Ũ��c(A�� )��c(Na+)�Ĵ�С��ϵ�� �� ��
A��ǰ�ߴ� B. ���ߴ� C. ������� D�����ж�
(3)�ӱ���ʵ�����������û����Һ������Ũ���ɴ�С��˳���� �� ��
(4)��������ʵ�����ݣ�д���û����Һ��������ʽ�ľ�ȷ���(��ʽ)��
c(Na+)��c(A-)= �� mol��L-1
(��)ij��Ԫ��(��ѧʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�
![]()
![]()
�ش��������⣺
(5)��0��1mol��L��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ���� �� ��
A.c( B2�� )+c(HB�� )=0��1mol��L B��c( B2�� )+ c(HB�� )+c(H2B)=0��1mol��L
C c(OH�� )=c(H+)+ c(HB�� ) D��c(Na+)+c(OH)=c(H+)+ c(HB�� )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ�����и߶�5���¿���ѧ�Ծ��������棩 ���ͣ������
ij��Ԫ��(��ѧʽ��H2A)��ʾ,��ˮ�еĵ��뷽��ʽ��:
H2A = H+ + HA-,
HA��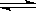 H+ +
A2�� �ش���������:
H+ +
A2�� �ش���������:
(1)Na2A��Һ�� (�����,���Ի���ԡ�),������,�����ӷ���ʽ��ʾ:
.
(2)��0.1 mol?L-1NaHA��Һ��pH = 2����0.1 mol?L-1H2A��Һ�������ӵ����ʵ���Ũ�ȿ�����___________0.11 mol?L-1(��>��<��=)��������_________________________
(3)0.1 mol?L-1NaHA��Һ�и�������Ũ���ɴ�С��˳����______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������и߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(5��)ij��Ԫ��(��ѧʽ��H2A��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�
H2A====H++HA��HA- H++A2-�ش��������⣺
H++A2-�ش��������⣺
(1)��0.1mol��L-1��Na2A��Һ�У�������Ũ�ȹ�ϵʽ��ȷ���ǣ�������
A��c(A2-)+c(HA-)+c(H2A)=0.1mol��L-1 B��c(OH-)=c(H+)+c(HA-)
C��c(Na+)+c(H+)==c(oH-)+c(HA-)+2c(A2-) D��c(Na+)=2c(A2-)+2c(HA-)
(2)��֪0.1mol��L-1NaHA��Һ��pH=2����0.1mol��L-1 H2A��Һ�������ӵ����ʵ���Ũ�ȿ���
�� 0.11 mol��L-1 (�<������>������=��)�������ǣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com