
【题目】关于铜晶体的堆积方式说法正确的是( )
A. 按ABABAB……方式堆积,配位数为12 B. 按ABABAB…方式堆积,配位数为8
C. 简单立方堆积,配位数为6 D. 按ABCABC……方式堆积,配位数为12
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】丙烯酸甲脂是—种重要的工业原料,某实验小组制取丙烯酸甲脂的装置如图所示: 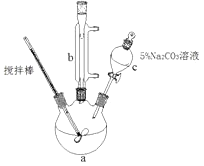
CH2=CHCOOH+HOCH3 ![]() CH2=CHCOOCH3+H2O
CH2=CHCOOCH3+H2O
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性。
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分。
可能用到的信息:
沸点 | 溶解性 | ||
丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
回答下列问题:
(1)仪器b的名称是。
(2)混合液用5%Na2CO3溶液洗涤的目的是。
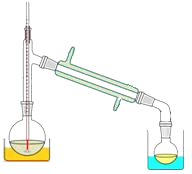
(3)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出、。![]()
![]()
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解。
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸18.00mL。
(4)计算本次酯化反应丙烯酸的转化率。
(5)请列举2条本实验中需要采取的安全防护措施、。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
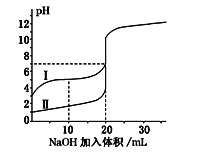
A. Ⅰ表示的是滴定盐酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C. V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
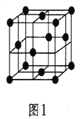
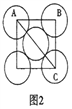
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH2=C(CH3)2和![]() 为原料可制备香料E(C11H12O2),其合成路线如下:
为原料可制备香料E(C11H12O2),其合成路线如下:
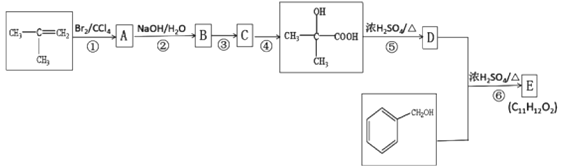
已知C 能发生银镜反应,D能使酸性高锰酸钾溶液褪色。请回答下列问题:
(1) 根据系统命名法有机物CH2=C(CH3)2的名称为___________;
(2) C 中能发生银镜反应的官能团名称是___________;
(3) ⑤的反应类型是_________;
(4) 写出⑥反应的化学方程式:__________________;
(5) 含苯环的![]() 的同分异构体有______种(不包含
的同分异构体有______种(不包含![]() ),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
),其中核磁共振氢谱图有4 組峰且能与FeCl3溶液发生显色反应的有机物的结构简式为________;
(6) 参照上述合成路线设计一条由乙烯制备聚乙二酸乙二酯的合成路线(无需注明反应条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,B和X均可与A形成10电子的化合物;B与Z的最外层电子数之比为2:3,化合物Y2X2与水反应生成X的单质,所得溶液可使酚酞变红。请回答下列问题。
(1)Z的原子结构示意图为_______,化合物BA4的电子式为__________。
(2)化合物Y2X2中含有的化学键类型有________________________。
(3)化合物A2X和A2Z中,沸点较高的是_________(填化学式),其主要原因是______。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
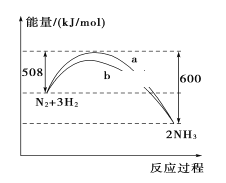
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常温、体积一定的条件下,通入1 mol N2和3 mol H2,反应后放出的热量为92 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B的转化率___________,v(正)__________。
(2)使用催化剂,A的物质的量___________。
(3)增大压强,v(逆)___________,C的产率___________。
(4)增大A的浓度,则B的转化率____________,C的物质的量_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com