
【题目】298 K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
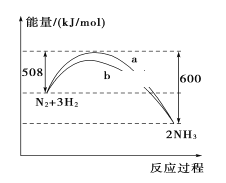
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常温、体积一定的条件下,通入1 mol N2和3 mol H2,反应后放出的热量为92 kJ
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:高中化学 来源: 题型:
【题目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铜晶体的堆积方式说法正确的是( )
A. 按ABABAB……方式堆积,配位数为12 B. 按ABABAB…方式堆积,配位数为8
C. 简单立方堆积,配位数为6 D. 按ABCABC……方式堆积,配位数为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应的ΔH_____ 0(填填“>”、“=”或“<”)。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol NH3溶于水后再与含有0.2mol H2SO4的稀溶液完全反应放热Q kJ,请你用热化学方程式表示其反应式:___________________________________。
(3)常温时,将a mol氨气溶于水后,再通入b mol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
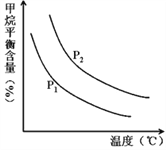
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会______(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5 L的容器中充入1mol H2O(g)和1mol CO, 反应达平衡后,测得CO的浓度0.08 mol/L,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
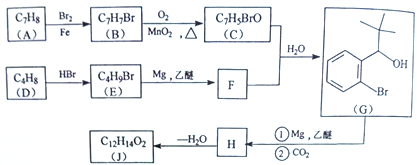
己知: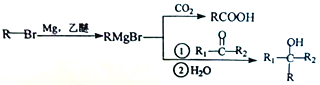
(1)G中官能团的名称为_________、_________。
(2)D的系统命名是_________。
(3)由A生成B的化学方程式为_________,反应类型_________。
(4)C与银氨溶液反应的化学方程式为________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_________。
(6)写出一种同时满足下面条件的G的同分异构体的结构简式_________。
①核磁共振氢谱有4组峰②能与FeCl3溶液发生显色反应
(7)借助题中信息写出以乙醛和苯为原料,合成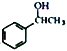 的路线流程图(其它试剂自选)。_________________________________________________________。
的路线流程图(其它试剂自选)。_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(s)+Y(g)![]() W(g)+Z(g)(正反应是放热反应),在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是( )
W(g)+Z(g)(正反应是放热反应),在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是( )

A. 增加了X的物质的量 B. 降低了温度
C. 增大了压强 D. 增大了Y的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl)制备碱式碳酸铜,其制备过程如下:
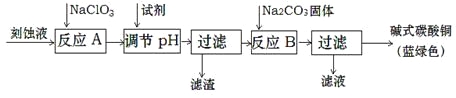
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。

①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com