
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ����� | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�Ӧ����H_____ 0����������������=��������������
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol NH3����ˮ�����뺬��0.2mol H2SO4��ϡ��Һ��ȫ��Ӧ����Q kJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ��___________________________________��
��3������ʱ����a mol��������ˮ����ͨ��b mol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
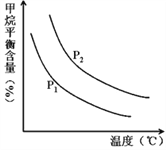
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2��������������=��������������
����������һ���������¶ȣ������IJ��ʻ�______������������������С����С�������������䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5 L�������г���1mol H2O��g����1mol CO�� ��Ӧ��ƽ����CO��Ũ��0.08 mol/L�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6
���𰸡� < ad NH3��H2O��aq��+H2SO4��aq���T�TNH4HSO4��aq��+H2O��l����H=��5Q kJmol��1 ![]() �� ���� 2.25 cd
�� ���� 2.25 cd
����������1���ٹ۲��������¶ȵ�����K��С����֪�÷�ӦΪ���ȷ�Ӧ����H�� 0��������ƽ��ʱH2��ת���ʣ��ı�����ʹƽ�������ƶ������Լ�ѹ�����£�����N2��Ũ�ȣ���С������Ũ�ȣ�����������ʹƽ���ƶ������Դ�ѡa��d����2��0.2mol NH3����ˮ��õ�0.2mol NH3��H2O�����뺬��0.2mol H2SO4��ϡ��Һ��ȫ��Ӧ����0.2mol NH4HSO4��ˮ������Q kJ��������1mol NH4HSO4ʱ�ų�������Ϊ��5Q kJ�����Ȼ�ѧ����ʽ��ʾ�䷴ӦʽΪ��NH3��H2O��aq��+H2SO4��aq���T�TNH4HSO4��aq��+H2O��l����H=��5Q kJmol��1����3����a molL-1�İ�ˮ��b molL-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L����Һ��c��NH4+��=c��Cl-��=![]() mol/L����Ϻ�Ӧǰc��NH3H2O��=
mol/L����Ϻ�Ӧǰc��NH3H2O��=![]() mol/L����Ӧ��c��NH3H2O��=��
mol/L����Ӧ��c��NH3H2O��=��![]() -
-![]() ��mol/L��Kb=
��mol/L��Kb=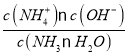 =
= =10-7
=10-7![]() ����4��������ͼ��仯��������ͬ�¶��£�CH4��g��+H2O ��g���TCO��g��+3H2��g������Ӧ�������������ķ�Ӧ��ѹǿԽ��ƽ�������ƶ�������ƽ�⺬��Խ�ߣ�����P1��P2����ѹǿһ�����¶����ߣ�����ƽ�⺬����С��ƽ�������ƶ��������IJ��ʻ�������
����4��������ͼ��仯��������ͬ�¶��£�CH4��g��+H2O ��g���TCO��g��+3H2��g������Ӧ�������������ķ�Ӧ��ѹǿԽ��ƽ�������ƶ�������ƽ�⺬��Խ�ߣ�����P1��P2����ѹǿһ�����¶����ߣ�����ƽ�⺬����С��ƽ�������ƶ��������IJ��ʻ�������
��5���ٸ��ݻ�ѧƽ������ʽ����ƽ��Ũ�ȣ�T��ʱ�����ݻ��̶�Ϊ5 L�������г���1mol H2O��g����1mol CO�� ��Ӧ��ƽ����CO��Ũ��0.08 mol/L��
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼŨ��(mol/L) 0.2 0.2 0 0
�ı�Ũ��(mol/L) 0.12 0.12 0.12 0.12
ƽ��Ũ��(mol/L) 0.08 0.08 0.12 0.12
����¶��·�Ӧ��ƽ�ⳣ��K=![]() =2.25��
=2.25��
�ڻ�ѧƽ��״̬����Ӧ�����淴Ӧ������ͬ�����ɷֺ������ֲ������ѡ���ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����������������Ӧ����a����Ӧ�����к�ƽ��״̬��ѹǿ��ͬ��������ѹǿ����ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��a�����ϣ�b���������������غ㣬��Ӧǰ������������䣬��Ӧ�����к�ƽ��״̬�£����������ܶȲ���ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��b�����ϣ�c����λʱ��������a mol CO2��ͬʱ����a mol H2 ��˵��������̼�����������淴Ӧ������ͬ��˵����Ӧ�ﵽƽ��״̬��ѡ��c���ϣ�d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6�����ݷ�Ӧǰ���������ʵ�����ͬ�������������ʵ�������Ũ�ȼ���Ũ���̺�ƽ�ⳣ���Ƚϣ�Q=
CO2��g��+H2��g����������������Ӧ����a����Ӧ�����к�ƽ��״̬��ѹǿ��ͬ��������ѹǿ����ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��a�����ϣ�b���������������غ㣬��Ӧǰ������������䣬��Ӧ�����к�ƽ��״̬�£����������ܶȲ���ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬��ѡ��b�����ϣ�c����λʱ��������a mol CO2��ͬʱ����a mol H2 ��˵��������̼�����������淴Ӧ������ͬ��˵����Ӧ�ﵽƽ��״̬��ѡ��c���ϣ�d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6�����ݷ�Ӧǰ���������ʵ�����ͬ�������������ʵ�������Ũ�ȼ���Ũ���̺�ƽ�ⳣ���Ƚϣ�Q=![]() =2.25=K��˵����Ӧ�ﵽƽ��״̬��ѡ��d���ϡ���ѡcd��
=2.25=K��˵����Ӧ�ﵽƽ��״̬��ѡ��d���ϡ���ѡcd��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��������������ɱ�������ͭ�ȡ�ʵ��С����ȡCuSO4��5H2O���岢�����ȷֽ��̽������ش�����������
̽��������ȡCuSO4��5H2O����
С��ͬѧ������������ַ�����
������ͭƬ��������Ũ�����в�����
������ͭƬ����ϡ���ᣬ����40��50�����μ�˫��ˮ
��1������������Ӧ�Ļ�ѧ����ʽΪ____________����Ӧ�������д�����ɫ��������������������ȡCuSO4��5H2O����ķ���������ʣ��Һ�壬____________��
��2�������ҷ�����Ӧ��Cu+H2SO4+H2O2=CuSO4+2H2O����ʵ�����40��50����ԭ����________���뷽������ȣ������ҵ���Ҫ�ŵ���_________��___________��(д��2��)
̽������������װ��(����װ��ʡ��)̽��CuSO4��5H2O�����ȷֽ����

��֪��CuSO4��5H2O��ˮ�������¶ȣ�������ֽ��CuO�����������������ܺ���SO3��SO2��O2�е�1��3�֡�
��3����5.00gCuSO4��5H2O��A�м��ȣ����۲쵽A�г���_____________���ɳ����жϾ�������ȫ��ˮ�������ֽ⡣����һ��ʱ���A�й�������Ϊ3.00g�����ʱA�й���ijɷ�Ϊ___________��
��4��װ��B��Ѹ�����ɰ�ɫ������˵���ֽ��������__________��Cװ�õ�������____________��
��5��������E��Ӧ�ռ���VmL���壬��ʵ�����ƫ�٣����ܵ�ԭ����______________��(������й©�Ƚ��������ԭ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᱵ(BaTiO3)�ڹ�ҵ������Ҫ��;����Ҫ�������������մɡ�PTC�������衢�������ȶ��ֵ���Ԫ�����������������ᱵ��һ�ֹ�������ͼ:
![]()
��֪:�ٲ��������ѱ�����Ļ�ѧʽΪBaTiO(C2O4)2��4H2O��
��25��ʱ��BaCO3���ܶȻ�Ksp=2.58��10-9��
(1)BaTiO3��TiԪ�صĻ��ϼ�Ϊ:__________��
(2)���������ʱ������Ӧ�����ӷ���ʽΪ: __________��
(3)������ͨ�����˵õ����������ѱ������Ϊ��߲�Ʒ������Ծ���ϴ�ӡ�
�ٹ��˲�����ʹ�õIJ���������_____________________��
�����֤��������ϴ��?_______________________��
(4)TiO2���кܺõ�ɢ���ԣ���һ������Ҫ��;�Ľ����������ҵ�Ͽ���TiCl4ˮ�����Ʊ����Ʊ�ʱ����������ˮ��ͬʱ���ȣ���Ŀ����:_______________��
(5)ij��ȤС��ȡ19.70gBaCO3ģ���������������Ʊ�BaTiO3���ò�Ʒ13.98g��BaTiO3�IJ���Ϊ:________��
(6)�������������������ʵ����BaCO3�ܽ�ƽ����ƶ���������Һ��c(Ba2+)=0.1mol/L����c(CO32-)�ڽ���Һ�е����Ũ��Ϊ__________ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH2=C(CH3)2��![]() Ϊԭ�Ͽ��Ʊ�����E(C11H12O2),��ϳ�·������:
Ϊԭ�Ͽ��Ʊ�����E(C11H12O2),��ϳ�·������:
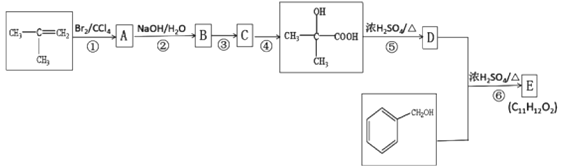
��֪C �ܷ���������Ӧ,D��ʹ���Ը��������Һ��ɫ����ش���������:
(1) ����ϵͳ�������л���CH2=C(CH3)2������Ϊ___________��
(2) C ���ܷ���������Ӧ�Ĺ�����������___________��
(3) �ݵķ�Ӧ������_________��
(4) д����Ӧ�Ļ�ѧ����ʽ:__________________��
(5) ��������![]() ��ͬ���칹����______��(������
��ͬ���칹����______��(������![]() )�����к˴Ź�������ͼ��4 �M��������FeCl3��Һ������ɫ��Ӧ���л���Ľṹ��ʽΪ________��
)�����к˴Ź�������ͼ��4 �M��������FeCl3��Һ������ɫ��Ӧ���л���Ľṹ��ʽΪ________��
(6) ���������ϳ�·�����һ������ϩ�Ʊ����Ҷ����Ҷ����ĺϳ�·��(����ע����Ӧ����)______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��X��Y��Z��ԭ���������ε����Ķ�����Ԫ�أ�����A��Yͬ���壬X��Zͬ���壬B��X������A�γ�10���ӵĻ����B��Z������������֮��Ϊ2:3��������Y2X2��ˮ��Ӧ����X�ĵ��ʣ�������Һ��ʹ��̪��졣��ش��������⡣
��1��Z��ԭ�ӽṹʾ��ͼΪ_______��������BA4�ĵ���ʽΪ__________��
��2��������Y2X2�к��еĻ�ѧ��������________________________��
��3��������A2X��A2Z�У��е�ϸߵ���_________���ѧʽ��������Ҫԭ����______��
��4��A��X��A��Z�����γ�18�����ӵĻ���������ֻ��������Ӧ�Ļ�ѧ����ʽΪ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�γɵ���Һ����ʹ��ɫʯ����ֽ��������
A.NH3B.Na2OC.NaHSO4D.KOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298 K��101kPaʱ��N2��H2��Ӧ�����������仯������ͼ�����������������(����)
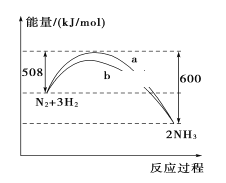
A. ������������ܸı�û�ѧ��Ӧ�ķ�Ӧ��
B. b�����Ǽ������ʱ�������仯����
C. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2(g)��3H2(g)![]() 2NH3(g)����H����92 kJ/mol
2NH3(g)����H����92 kJ/mol
D. �ڳ��¡����һ���������£�ͨ��1 mol N2��3 mol H2����Ӧ��ų�������Ϊ92 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��CO�ǻ�����Ⱦ�����壬����Pt2O+ ����ת��Ϊ�����壬�䷴Ӧԭ��ΪN2O(g) + CO(g)![]() CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
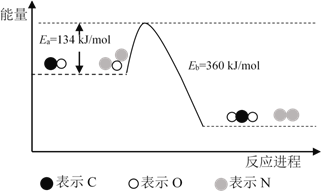
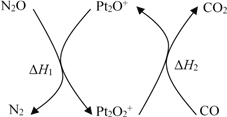
A. ��H = ��H1 + ��H2
B. ��H = 226 kJ/mol
C. �÷�Ӧ����Ӧ�Ļ��С���淴Ӧ�Ļ��
D. Ϊ��ʵ��ת���費����Ӧ���в��� Pt2O+ �� Pt2O2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ��Ҳ��̼Ԫ��һ������һϵ���⻯��,��NH3��N2H4��N3H5��N4H6�ȡ���ش������й����⣺
��1����������ϵ���⻯���ͨʽΪ____________��
��2����֪��2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ��mol-1,�����������ϣ���ѧ���������±���
��ѧ�� | H-H | N=N | N-H |
E/kJ��mol-1 | 436 | 946 | 391 |
�����ֽⷴӦNH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)�Ļ��Ea1=300kJ��mol-1����ϳɰ���Ӧ
H2(g)�Ļ��Ea1=300kJ��mol-1����ϳɰ���Ӧ![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)�Ļ��Ea2=___________��
NH3(g)�Ļ��Ea2=___________��
��������ȫȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽΪ__________________________��
������ͼ�ǰ���ȼ�ϵ��ʾ��ͼ��a�缫�ĵ缫��ӦʽΪ________________��
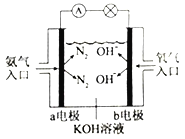
��3����֪NH3��H2OΪһԪ���N2H4��H2OΪ��Ԫ�����ˮ��Һ�е�һ�����뷽��ʽ��ʾΪ��N2H4��H2O+H2O![]() N2H5��H2O++OH-�����������������(N2H6Cl2)��һ��ˮ������ӷ���ʽΪ__________________;��Һ������Ũ���ɴ�С������˳��Ϊ___________________��
N2H5��H2O++OH-�����������������(N2H6Cl2)��һ��ˮ������ӷ���ʽΪ__________________;��Һ������Ũ���ɴ�С������˳��Ϊ___________________��
��4��ͨ�������ж�(NH4)2SO3��Һ�������(д���������)________________________��(��֪����ˮKb=1.8��10-5;H2SO3 Ka1=1.3��10-2Ka2=6.3��10-8)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com