
【题目】下列关于金属铬的叙述中不正确的是( )
A. 铬元素在周期表中处于第四周期VIB族
B. 铬原子的外围电子层排布为3d44s2
C. 铬原子中,质子数为24
D. 铬元素位于元素周期表的d区,是过渡元素
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料树取液态TiCl4的装置如图所示(部分夹持装置省略)。
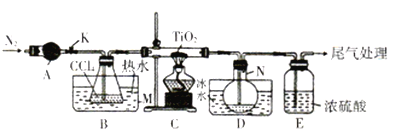
已知:有关物质的性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550 ℃时能被氧气氧化 |
请回答下列问题:
(1)仪器A的名称是________,仪器A中盛装的试剂是___________。
(2)CCl4的电子式为__________。
(3)装置C处硬质玻管中反应的化学方程式为__________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为________________。
(5)仪器N中收集到的物质主要有___________(写化学式),从产物中分离出TiCl4的实验方法是_____________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2∶1的CO和CO2混合气体,该反应中氧化剂与还原剂的物质的量之比为________。请设计实验方案验证产物气体中有CO:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有______和______。
(2)锌与盐酸反应速率可以通过观察_________进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是_______或 _____。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH |
阴离子 | CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是_____________,B是____________(填化学式) 。用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____________(填微粒浓度符号)=_____________(用含有a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_____________。
(4)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(6)现使用酸碱中和滴定法测定酸的浓度。在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测酸溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. 由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,可知金刚石比石墨稳定
C. 自发反应的熵一定增大,非自发反应的熵一定减小
D. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲烷是目前使用量非常大的一种清洁燃料。
(1)甲烷的电子式为_________,空间构型为__________,二氯甲烷的结构共有_____种。
(2)标准状况下,2.24L甲烷完全燃烧生成液态水和二氧化碳气体时可以放出89.1kJ的热量。请写出甲烷完全燃烧的热化学方程式_________________________________________。该燃烧反应也可设计成燃料电池,则通入甲烷的一端应该为原电池的______极。
II.1molH2(g)和1mol Cl2(g)在一定条件下反应生成2 mol HCl(g),放出184.5KJ的热量,已知断裂1molH2(g)中的H-H和1mol Cl2(g)中的Cl-Cl分别需要吸收436.4KJ和242.7KJ的能量,则1mol HCl分子中的化学键形成时释放_________KJ的能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是( )
选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液 | 变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液 | 褪色 | Cl2具有漂白性 |
C | 紫色石蕊溶液 | 先变红后褪色 | Cl2具有酸性、漂白性 |
D | KI淀粉溶液 | 变蓝色 | Cl2具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 2-甲基丁烷也称异丁烷
B. 由乙烯生成乙醇属于加成反应
C. C4H9Cl有3种同分异构体
D. 油脂和蛋白质都属于高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com