
【题目】将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是( )
选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液 | 变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液 | 褪色 | Cl2具有漂白性 |
C | 紫色石蕊溶液 | 先变红后褪色 | Cl2具有酸性、漂白性 |
D | KI淀粉溶液 | 变蓝色 | Cl2具有氧化性 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示。下列分析不正确的是( )

A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B. 0~3min内,v(X)=0.1 mol/(Lmin)
C.若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强
D.达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属铬的叙述中不正确的是( )
A. 铬元素在周期表中处于第四周期VIB族
B. 铬原子的外围电子层排布为3d44s2
C. 铬原子中,质子数为24
D. 铬元素位于元素周期表的d区,是过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL 5 mol/L的HCl溶液稀释到200 mL,从中取出5 mL,这5 mL溶液的物质的量浓度为( )
A. 0.5 mol/L B. 0.25 mol/L C. 0.1 mol/L D. 1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列有关说法正确的是

A. a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)=0.lmol/L
B. b点所示溶液中:c (Na+) >c(HR-)> c (H2R)>c(R2-)
C. 对应溶液的导电性:b > c
D. a、b、c、d中,d点所示溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

结合实验,下列说法不正确的是
A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol<n(CO2)![]() 0.015时发生的反应是:2NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
0.015时发生的反应是:2NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)>c(HCO3-)> c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程。
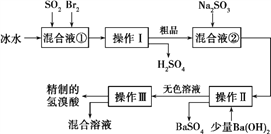
根据上述流程回答下列问题:
(1)混合液①中发生反应的化学方程式为________________________。
(2)溴与氯结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为___________________。
(3)加入Ba(OH)2反应的离子方程式为______________操作Ⅱ的名称是______。操作Ⅲ一般适用于分离______混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有F![]() ,则用于证明该假设所用的试剂为______,反应的离子方程式为_____________。
,则用于证明该假设所用的试剂为______,反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的强碱性溶液中,能大量共存的离子组是
A. Na+、K+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Na2+、K+、Cl-、SO42- D. NH4+、K+、NO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com