
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示。下列分析不正确的是( )

A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B. 0~3min内,v(X)=0.1 mol/(Lmin)
C.若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强
D.达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正>v逆
【答案】C
【解析】
试题分析:A.由t1知,X的物质的量减少量为(2.0-1.4)mol=0.6mol,Y的物质的量减少量为(1.6-1.4)mol=0.2mol,X、Y为反应物;Z的物质的量增加量为(0.8-0.4)mol=0.4mol,Z为生成物,同一化学反应同一时间段内,反应物减少的物质的量和生成物增加的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,所以反应可表示为:3X(g)+Y(g)![]() 2Z(g),故A正确;B.0~3min内,v(X)=
2Z(g),故A正确;B.0~3min内,v(X)=![]() =0.1mol/(L.min),故B正确;C.由图1和图3知,反应物和生成物的变化量不变,但反应时间减小,说明改变的条件不影响化学平衡只影响反应速率,且该反应是一个反应前后气体体积减小的反应,所以只能是使用催化剂,故C错误;D.升高温度,正逆反应速率同时增大;由t2知“先拐平数值大”,所以T2>T1,升高温度Y的含量减少,平衡向正反应方向移动,则正反应速率大于逆反应速率,即v正>v逆,故D正确;故选C。
=0.1mol/(L.min),故B正确;C.由图1和图3知,反应物和生成物的变化量不变,但反应时间减小,说明改变的条件不影响化学平衡只影响反应速率,且该反应是一个反应前后气体体积减小的反应,所以只能是使用催化剂,故C错误;D.升高温度,正逆反应速率同时增大;由t2知“先拐平数值大”,所以T2>T1,升高温度Y的含量减少,平衡向正反应方向移动,则正反应速率大于逆反应速率,即v正>v逆,故D正确;故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】橙花醇具有玫瑰及苹果香气,可作为香料。其结构简式如下:
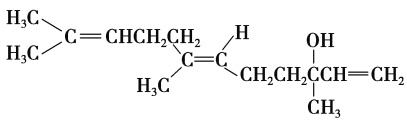
下列关于橙花醇的叙述,错误的是
A.既能发生取代反应,也能发生加成反应
B.橙花醇分子中有1个手性碳原子
C.橙花醇分子中所有碳原子有可能都在同一平面上
D.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料树取液态TiCl4的装置如图所示(部分夹持装置省略)。
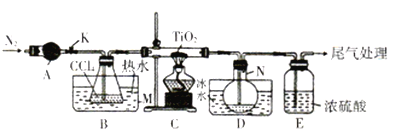
已知:有关物质的性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550 ℃时能被氧气氧化 |
请回答下列问题:
(1)仪器A的名称是________,仪器A中盛装的试剂是___________。
(2)CCl4的电子式为__________。
(3)装置C处硬质玻管中反应的化学方程式为__________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为________________。
(5)仪器N中收集到的物质主要有___________(写化学式),从产物中分离出TiCl4的实验方法是_____________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2∶1的CO和CO2混合气体,该反应中氧化剂与还原剂的物质的量之比为________。请设计实验方案验证产物气体中有CO:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的二价阳离子(R2+)核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A. 18 B. 20 C. 16 D. 22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
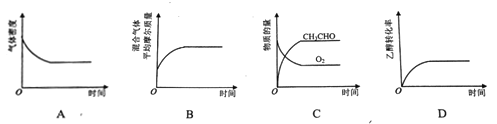
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5, ![]() ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在10 mL浓度均为0.1 mol/LNaOH和NH3·H2O混合溶液中滴加0.1 mol/L盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)
B.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
C.加入10 mL盐酸时:c(NH![]() )+c(H+)=c(OH-)
)+c(H+)=c(OH-)
D.加入20 mL盐酸时:c(Cl-)=c(NH![]() )+c(Na+)
)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有______和______。
(2)锌与盐酸反应速率可以通过观察_________进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是_______或 _____。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是( )
选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液 | 变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液 | 褪色 | Cl2具有漂白性 |
C | 紫色石蕊溶液 | 先变红后褪色 | Cl2具有酸性、漂白性 |
D | KI淀粉溶液 | 变蓝色 | Cl2具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com