
【题目】某元素的二价阳离子(R2+)核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A. 18 B. 20 C. 16 D. 22
科目:高中化学 来源: 题型:
【题目】与淀粉相关的物质间转化关系如下图所示。其中B的分子中含有一个甲基,B与羧酸和醇均能发生酯化反应;C的催化氧化产物既是合成酚醛树脂的原料之一,又是常见的居室污染物;E能使Br2的CCl4溶液褪色。

(1)B的结构简式是_____________________________。
(2)E→F的化学方程式是___________________________。
(3)某同学欲验证淀粉完全水解的产物A,进行如下实验操作:①在试管中加入少量淀粉溶液;②加热3~4 min;③加入少量新制的Cu(OH)2悬浊液;④加入少量稀硫酸;⑤加热;⑥待冷却后,滴加NaOH溶液至溶液呈碱性。则以上操作步骤正确的顺序是(填选项序号)_____________。
A.①②④⑤③⑥ | B.①④②③⑤⑥ | C.①④②⑥③⑤ | D.①⑤③④⑥② |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M(C25H44O8)是一种新型治疗高血压病的药物,工业上用淀粉、烃A为基本原料合成M的路线如下图所示。
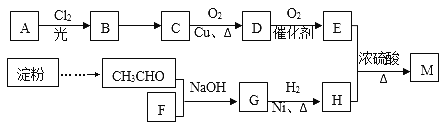 已知:
已知:
I.烃A在质谱图中的最大质荷比为72,B分子中核磁共振氢谱有2个峰且面积比为9:2,35%-40%的F的水溶液被称为福尔马林。
II.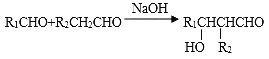
(1)A的名称为__________(系统命名法),B的结构简式为_______________,F的分子式为_____________;
(2)B→C的反应条件是______________,G的官能团名称是_____________;
(3)D与银氨溶液反应的方程式_____________________;
(4)E与H反应生成M的方程式___________________;
(5)E有多种同分异构体,其中能发生银镜反应且属于酯类的同分异构体共有____________种,其中核磁共振氢谱有2个峰的物质结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些中国古文或谚语包含了丰富的化学知识,下列解释不合理的是
选项 | 古文或谚语 | 化学解释 |
A | 粉身碎骨浑不怕,要留清白在人间 | 发生了化学变化 |
B | 以曾青涂铁,铁赤色如铜 | 化合反应 |
C | 煮豆燃豆箕 | 化学能转化为热能 |
D | 雷雨肥庄稼 | 自然固氮 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铬单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子轨道表示式为________________;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于_________________。
(2)配合物CrCl3·6H2O的配位数为6,它有三种不同组成、不同颜色的固体,其中一种为浅绿色固体,该固体与足量硝酸银溶液反应时,0.5mol固体可生成1mol氯化银沉淀,则这种浅绿色固体的配体个数比(Cl-:H2O)为_____________。
II.砷化镓为第三代半导体材料,晶胞结构如图所示:

(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为__________。
(4)AsH3分子的立体构型为__________,其中As原子的杂化方式是______。1个(CH3)3Ga分子中含有_________个σ键,砷的第一电离能_______(填“>”或“<”)镓的第一电离能。
(5)砷化镓晶休中砷和镓的最近原子核间距为a nm,砷化镓的摩尔质量为bg·mol-1,阿伏加德罗常数值为NA,则砷化镓晶体的密度表达式是_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() U原子核的中子数与质子数之差为____________。
U原子核的中子数与质子数之差为____________。
(2)为了便于理解物质的组成,Fe3O4可改写为FeO· Fe2O3 则 Pb3O4可改写为:__________。
(3)O3、NH4NO3、K2O2、N2H4四种物质中,既有离子键又有非极性键的是_____________。
(4)金刚石、NaOH、干冰三物质中,熔化时需要破坏共价键的是________。
(5)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是共价化合物,可以证明该判断正确的实验依据是_____ (填字母序号)
A.AlCl3 可溶于水 B.AlCl3溶液可导电 C.熔化态的AlCl3不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示。下列分析不正确的是( )

A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
B. 0~3min内,v(X)=0.1 mol/(Lmin)
C.若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强
D.达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应:__________________;银片上发生的电极反应:_________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况)___________L;
②通过导线的电量________C。(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL 5 mol/L的HCl溶液稀释到200 mL,从中取出5 mL,这5 mL溶液的物质的量浓度为( )
A. 0.5 mol/L B. 0.25 mol/L C. 0.1 mol/L D. 1 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com