
【题目】(1)![]() U原子核的中子数与质子数之差为____________。
U原子核的中子数与质子数之差为____________。
(2)为了便于理解物质的组成,Fe3O4可改写为FeO· Fe2O3 则 Pb3O4可改写为:__________。
(3)O3、NH4NO3、K2O2、N2H4四种物质中,既有离子键又有非极性键的是_____________。
(4)金刚石、NaOH、干冰三物质中,熔化时需要破坏共价键的是________。
(5)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是共价化合物,可以证明该判断正确的实验依据是_____ (填字母序号)
A.AlCl3 可溶于水 B.AlCl3溶液可导电 C.熔化态的AlCl3不导电
【答案】 51 2PbO·PbO2 K2O2 金刚石 C
【解析】(1)![]() U原子核的中子数与质子数之差为(235-92)-92=51;(2)Pb3O4中铅的化合价为+2和+4价,Pb3O4可改写为:2PbO·PbO2 ;(3)O3中只含有非极性共价键;NH4NO3中氯离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子之间、硝酸根离子中氮原子和氧原子之间存在极性共价键,既有离子键又有极性键;K2O2中钾离子与过氧根离子以离子键结合,O、O之间以非极性共价键结合,既有离子键又有非极性键;N2H4中既含有极性共价键,又含有非极性共价键;故O3、NH4NO3、K2O2、N2H4四种物质中,既有离子键又有非极性键的是K2O2;(4)熔化时需要破坏共价键的是金刚石;熔化时不需要破坏化学键的是CO2,熔化时需要破坏离子键的是NaOH,故金刚石、NaOH、干冰三物质中,熔化时需要破坏共价键的是金刚石。(5)氯化铝是共价化合物,在熔融状态下不导电,故选C。
U原子核的中子数与质子数之差为(235-92)-92=51;(2)Pb3O4中铅的化合价为+2和+4价,Pb3O4可改写为:2PbO·PbO2 ;(3)O3中只含有非极性共价键;NH4NO3中氯离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子之间、硝酸根离子中氮原子和氧原子之间存在极性共价键,既有离子键又有极性键;K2O2中钾离子与过氧根离子以离子键结合,O、O之间以非极性共价键结合,既有离子键又有非极性键;N2H4中既含有极性共价键,又含有非极性共价键;故O3、NH4NO3、K2O2、N2H4四种物质中,既有离子键又有非极性键的是K2O2;(4)熔化时需要破坏共价键的是金刚石;熔化时不需要破坏化学键的是CO2,熔化时需要破坏离子键的是NaOH,故金刚石、NaOH、干冰三物质中,熔化时需要破坏共价键的是金刚石。(5)氯化铝是共价化合物,在熔融状态下不导电,故选C。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有C3H8气体,另—个盛有N2O和CO2的混合气体。在同温同压下,两容器内的气体一定具有相同的①分子数②密度③质量④质子数⑤原子数
A. ①②③ B. ①②⑤ C. ③④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
①若在500℃时进行反应,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为 。
②800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
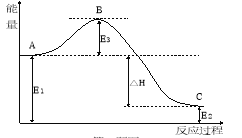
该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低” )△H (填“变大”、“变小”或“不变”);
(3)已知某反应的平衡常数表达式为:![]() ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cl2通入液复水中发生3Cl2+8NH3·H2O =6NH4Cl+N2+8H2O.下列说法正确的是
A. 浓氨水是弱电解质
B. Cl2的氧化性比N2的强
C. 向1L 0.1mol/L氨水加入盐酸至显中性,生成NH4+数为0.1×6.02×1023
D. 常温常压下,上述反应每生成2.24LN2,转移电子数为0.6×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的二价阳离子(R2+)核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A. 18 B. 20 C. 16 D. 22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周
期序数与族序数相等,请回答下列问题:
Q | R | ||
T | W |
(1)T的原子结构示意图为____________
(2)元素原子的得电子能力为Q____W(填“>”或“<”)。
(3)W的单质与其最高价氧化物对应的水化物浓溶液共热能发生反应,生成两种物质,其中一种是具有漂白性的气体,反应的化学方程式为
________________________________________________________________________
(4)原子序数比R多1的元素的一种氢化物在二氧化锰催化作用下易分解为它的另一种氢化物,此分解反应的化学方程式是
________________________________________________________________________
(5)将12 g Q单质在足量的氧气中燃烧,所得气体通入1 L 1.5 mol·L-1NaOH溶液中,完全吸收后,溶液中大量存在的离子有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在10 mL浓度均为0.1 mol/LNaOH和NH3·H2O混合溶液中滴加0.1 mol/L盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)
B.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
C.加入10 mL盐酸时:c(NH![]() )+c(H+)=c(OH-)
)+c(H+)=c(OH-)
D.加入20 mL盐酸时:c(Cl-)=c(NH![]() )+c(Na+)
)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生课外活动小组利用右图所示装置分别做如下实验:

(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是_________溶液;加热时溶液由红色逐渐变浅的原因是:________________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是: ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com