
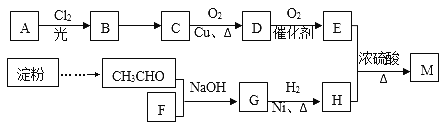
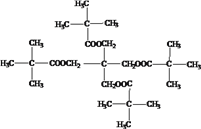
����Ŀ���л���M(C25H44O8)��һ���������Ƹ�Ѫѹ����ҩ���ҵ���õ��ۡ���AΪ����ԭ�Ϻϳ�M��·������ͼ��ʾ��
 ��֪��
��֪��
I����A������ͼ�е�����ʺɱ�Ϊ72��B�����к˴Ź���������2�����������Ϊ9:2��35%-40%��F��ˮ��Һ����Ϊ����������
II��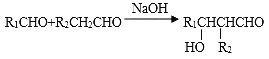
��1��A������Ϊ__________��ϵͳ����������B�Ľṹ��ʽΪ_______________��F�ķ���ʽΪ_____________��
��2��B��C�ķ�Ӧ������______________��G�Ĺ�����������_____________��
��3��D��������Һ��Ӧ�ķ���ʽ_____________________��
��4��E��H��Ӧ����M�ķ���ʽ___________________��
��5��E�ж���ͬ���칹�壬�����ܷ���������Ӧ������������ͬ���칹�干��____________�֣������˴Ź���������2��������ʽṹ��ʽΪ________________��
���𰸡� 2��2���������� 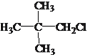 CH2O ��������ˮ��Һ������ ȩ�����ǻ�
CH2O ��������ˮ��Һ������ ȩ�����ǻ� 
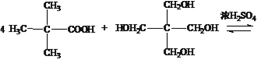
 +4H2O 4
+4H2O 4 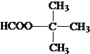
����������A������ͼ�е�����ʺɱ�Ϊ72������A�ķ���ʽΪC5H12��B�����к˴Ź���������2�����������Ϊ9:2����B�Ľṹ��ʽΪ ��BΪA�������ڹ��������µIJ����AΪ
��BΪA�������ڹ��������µIJ����AΪ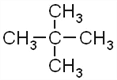 ��C��D����������������Ӧ����CΪ����DΪȩ��EΪ���ᣬ��B��CΪ±������NaOH��Һ�з�����ˮ�ⷴӦ����CΪ
��C��D����������������Ӧ����CΪ����DΪȩ��EΪ���ᣬ��B��CΪ±������NaOH��Һ�з�����ˮ�ⷴӦ����CΪ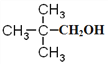 ��DΪ
��DΪ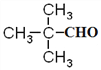 ��EΪ
��EΪ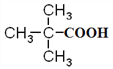 ��35%-40%��F��ˮ��Һ����Ϊ�������֣���FΪHCHO��HCHO��CH3CHO��NaOH��Һ�����������ɵ�GΪ
��35%-40%��F��ˮ��Һ����Ϊ�������֣���FΪHCHO��HCHO��CH3CHO��NaOH��Һ�����������ɵ�GΪ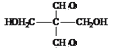 ��
�� ����H2�����ӳɷ�Ӧ���ɵ�HΪ
����H2�����ӳɷ�Ӧ���ɵ�HΪ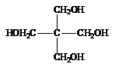 ��
�� ��
�� ��Ũ����������������õ���M����ʽΪC25H44O8������̼ԭ���غ㣬��֪MΪ
��Ũ����������������õ���M����ʽΪC25H44O8������̼ԭ���غ㣬��֪MΪ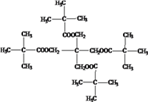 ��
��
��1������ϵͳ���������л��� ������Ϊ2��2���������飬B�Ľṹ��ʽΪ
������Ϊ2��2���������飬B�Ľṹ��ʽΪ ��HCHO�ķ���ʽΪCH2O ��
��HCHO�ķ���ʽΪCH2O ��
��2����B��CΪ±������ˮ�ⷴӦ����Ӧ��������������ˮ��Һ�����ȣ��л��� �Ĺ�����������ȩ�����ǻ���
�Ĺ�����������ȩ�����ǻ���
��3�� ��������Һ��Ӧ�ķ���ʽΪ
��������Һ��Ӧ�ķ���ʽΪ ��
��
��4�� ��
�� ��Ũ����������������õ�M�ķ���ʽΪ
��Ũ����������������õ�M�ķ���ʽΪ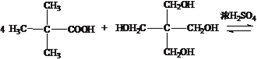
 +4H2O��
+4H2O��
��5�� �ж���ͬ���칹�壬�����ܷ���������Ӧ�����������ͬ���칹����������������4�֣��������ҲӦ����4�֣����к˴Ź���������2��������ʽṹ��ʽΪ
�ж���ͬ���칹�壬�����ܷ���������Ӧ�����������ͬ���칹����������������4�֣��������ҲӦ����4�֣����к˴Ź���������2��������ʽṹ��ʽΪ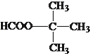 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫ֤������������Ԫ�صĴ��ڿɽ������²���������˳����ȷ����
������AgNO3��Һ��������NaOH��Һ�������ȣ�����������ˮ��������HNO3�ữ
A���ڢۢݢ� B���ܢۢݢ� C���ܢ٢� D���ڢۢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�������õ�弰ƻ������������Ϊ���ϡ���ṹ��ʽ���£�
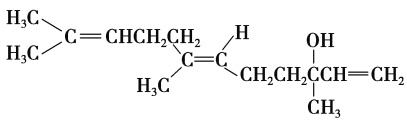
���й��ڳȻ������������������
A�����ܷ���ȡ����Ӧ��Ҳ�ܷ����ӳɷ�Ӧ
B���Ȼ�����������1������̼ԭ��
C���Ȼ�������������̼ԭ���п��ܶ���ͬһƽ����
D����Ũ������¼�����ˮ���������ɲ�ֹһ����ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ��һ��ԭ�ӵ�����Ϊa g, 12C��һ��ԭ��������bg��NA�ǰ���٤��������ֵ������˵������ȷ���ǣ� ��
A. ����Ϣ��֪NA=![]()
B. ��ԭ�ӵ�Ħ��������aNA g/mol
C. w g��ԭ�ӵ����ʵ���һ����![]() mol
mol
D. w g��ԭ���к���![]() ����ԭ��
����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫ����ǿУ.�����е�һ��ѧ2017�������ѧ�ڵ�һ���¿��������£���10mL0.1mol��L-1��HR��Һ������0.1mol��L-1��NH3��H2O��Һ��������ҺpH�����������仯��ͼ�����з�������ȷ����

A. a��b�㵼��������ǿ��˵��HRΪ����
B. b����ҺpH=7,��ʱ���ǡ���к�
C. b��c����ˮ�ĵ���̶ȣ�b<c
D. c����Һ����c(NH4+)>c(R-)��c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1��ú����ͨ��ͨ���о���ͬ�¶��µ�ƽ�ⳣ���Խ������ʵ�����⡣��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��
CO(g)+H2O(g)![]() H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
������500��ʱ���з�Ӧ����CO��H2O����ʼŨ�Ⱦ�Ϊ0.020mol/L���ڸ������£�CO��ƽ��ת����Ϊ ��
��800��ʱ,�ڹ̶��ݻ����ܱ������з�������,��ʼŨ��Ϊ��c(CO)=0.01mol/L��c(H2O)=0.03mol/L��c(CO2)=0.01mol/L�� c(H2)=0.05mol/L ,����Ӧ��ʼʱ��H2���������ʱ��������� (�����С������ȷ����)��
��2��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ�����е������仯��ͼ��ʾ������֪1molSO2(g)����Ϊ1molSO3(g)�Ħ�H=-99 kJ��mol-1����ش����⣺
2SO3(g)��Ӧ�����е������仯��ͼ��ʾ������֪1molSO2(g)����Ϊ1molSO3(g)�Ħ�H=-99 kJ��mol-1����ش����⣺
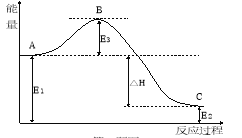
�÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�� (����ߡ����͡� )��H (��������С�����䡱)��
��3����֪ij��Ӧ��ƽ�ⳣ������ʽΪ��![]() ��������Ӧ��Ӧ�Ļ�ѧ����ʽΪ
��������Ӧ��Ӧ�Ļ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(TiCl4)����ȡ���칤ҵ���ϡ����ѺϽ����Ҫԭ�ϡ�ʵ������TiO2��CCl4Ϊԭ����ȡҺ̬TiCl4��װ����ͼ��ʾ�����ּг�װ��ʡ�ԣ���
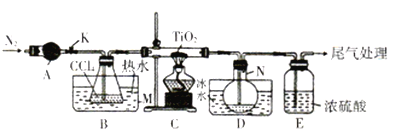
��֪���й����ʵ��������±���
���� | �۵�/�� | �е�/�� | ���� |
CCl4 | -23 | 76 | ��TiCl4���� |
TiCl4 | -25 | 136 | ����ʪ����������������550 ��ʱ�ܱ��������� |
��ش��������⣺
��1������A��������________������A��ʢװ���Լ���___________��
��2��CCl4�ĵ���ʽΪ__________��
��3��װ��C��Ӳ�ʲ����з�Ӧ�Ļ�ѧ����ʽΪ__________________��
��4��TiCl4����ʪ���������TiO2����Ӧ�Ļ�ѧ����ʽΪ________________��
��5������N���ռ�����������Ҫ��___________��д��ѧʽ�����Ӳ����з����TiCl4��ʵ�鷽����_____________��
��6��TiCl4������TiO2����̿�������ڼ����������Ƶã����������Ϊ2��1��CO��CO2������壬�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________�������ʵ�鷽����֤������������CO:_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�صĶ��������ӣ�R2+��������18�����ӣ�������Ϊ42����Ԫ��ԭ�ӵ�ԭ�Ӻ��е�������Ϊ�� ��
A. 18 B. 20 C. 16 D. 22
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Zn����ϡ���ᷴӦһ��ʱ���Ӧ���ʻ�����������Ȼ����Ũ�����Ӧ�������Լӿ졣�ɴ��жϣ�Ӱ�컯ѧ��Ӧ���ʵ�������______��______��
��2��п�����ᷴӦ���ʿ���ͨ���۲�_________�����жϣ�Ҳ��ͨ��ʵ��ⶨ��ͨ��ʵ��ⶨп�����ᷴӦ���ʣ���������Ӧʱ���⣬����Ҫ��������������_______�� _____��
��3��Ϊ̽��п�����ᷴӦ���̵����ʱ仯��ijͬѧ��ʵ��ⶨ�����ǣ���100mlϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£���������ѻ���Ϊ��״������
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
���/mL | 50 | 120 | 232 | 290 | 310 |
����һʱ��η�Ӧ�������_______���0~1 min����1~2 min����2~3 min����3~4 min����4~5min������
��2~3 minʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ���ʣ�����Һ������䣩Ϊ____________��
���Է���1~3minʱ������Ӧ���ʱ�����Ҫԭ��_________________________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com