
【题目】Ⅰ.某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
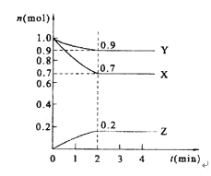
(1)反应物为____________生成物为_____________;
(2)由图中所给数据进行分析,该反应的化学方程式为__________________________;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_________;
(4)当反应进行了3 min,该反应是否达到平衡___________(填“是”或“否”)。
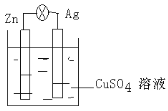
Ⅱ.在银锌原电池中,以硫酸铜为电解质溶液,锌为___________极,电极上发生的是___________反应(“氧化”或“还原”)。银为___________极,电极反应式是_________________。
【答案】X、Y Z 3X+Y![]() 2Z 0.05mol·L-1·min-1 是 负 氧化反应 正 Cu2++2e-=Cu
2Z 0.05mol·L-1·min-1 是 负 氧化反应 正 Cu2++2e-=Cu
【解析】
Ⅰ.(1)根据图中曲线走势可知,X、Y的物质的量在减小,Z的物质的量在增加,故反应物为X、Y,生成物为Z;
(2)△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,△n(X):△n(Y):△n(Z)=3:1:2,且反应至2分钟起各物质的物质的量不再发生改变,此反应为可逆反应,结合(1)得出化学方程式为3X+Y![]() 2Z;
2Z;
(3)v(Z)=△c(Z)/△t=△n(Z)/V△t=0.2mol/(2L×2min)= 0.05mol·L-1·min-1;
(4)反应至2分钟起各物质的物质的量不再发生改变,反应达到了平衡,3 min时反应依然是平衡状态。
Ⅱ.银锌原电池以硫酸铜为电解质溶液,由于金属活泼性锌大于银,且只有锌能与硫酸铜反应,故锌做负极,失电子,发生氧化反应,银做正极,铜离子得电子,发生还原反应,电极反应式为Cu2++2e-=Cu。
答案为Ⅰ.(1) X、Y,Z;
(2) 3X+Y![]() 2Z;
2Z;
(3) 0.05mol·L-1·min-1;
(4) 是;
Ⅱ. 负极,氧化反应,正极,Cu2++2e-=Cu。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】某烃的化学式为C8H10,能使酸性KMnO4溶液褪色。
(1)若分子中含有一个苯环,则该烃属于_____,是_____的同系物。该烃具有_____种同分异构体。
(2)若为链烃且有两个甲基取代基,写出一种分子中只含叁键的同分异构体的结构简式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为九种主族元素在周期表中的位置:
A | |||||||
E | F | ||||||
B | D | I | G | ||||
C | H | ||||||
请回答下列问题:
(1)I元素的位置是第________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为_______(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与水反应的离子方程式为_______。
(5)用电子式表示A和G形成化合物的过程:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:
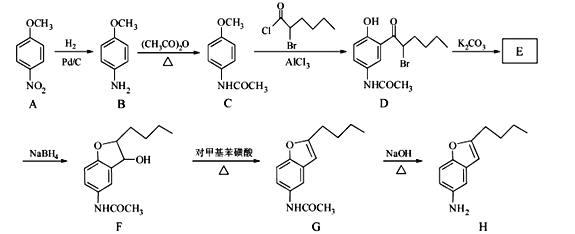
(1)D中的含氧官能团名称为_____________(写两种)。
(2)F→G的反应类型为_____________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式_________________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子式为C14H17O3N,写出E的结构简式_____________。
(5)G→H的反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有毒气体。请回答下列问题:
(1)Q的离子结构示意图是__________________。
(2)六种元素中,原子半径最大的是___________。(写元素符号)
(3)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)____________。
(4)Y和Z的气态氢化物中,热稳定性强的是________(用物质化学式表示)。
(5)Y的气态氢化物与X和M形成的化合物反应,产物的化学式为________,其中存在的化学键类型为____________________。
(6)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_______________________________________________________________。
(7)单质M与水反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积固定的密闭容器中加入反应物A、B,发生反应:A(g)+2B(g)=3C(g)。反应2 min后,A的浓度从开始时的1.0 mol·L-1降到0.8 mol·L-1。已知反应开始时B的浓度是1.2 mol·L-1。求:(1)2 min末B、C的浓度____。(2)以单位时间内A的浓度的减小来表示2 min内该反应的平均速率_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是( )
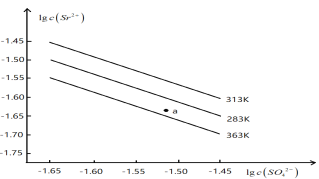
A. 温度一定时, Ksp(SrSO4)随c(SO42-)的增大而减小
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 363 K时,图中a点对应的溶液是不饱和溶液
D. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:N2(g)+3H2(g) 2NH3(g) △H 该反应的能量变化如图所示。
2NH3(g) △H 该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是:______________。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:![]()
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=_______________,H2的转化率为_______________,该反应在此温度下的化学平衡常数为_______________。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是____________。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为_____________________。

(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g) +6H2O(l) ![]() 4NH3(g) +3O2(g) △H = a kJ/mol
4NH3(g) +3O2(g) △H = a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
A. 231.5mL B. 268.8mL C. 287.5mL D. 313.6mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com