
【题目】下列现象与氢键有关的是( )
①NH3的沸点比PH3的高
②乙醇能与水以任意比混溶,而甲醚(![]() )难溶于水
)难溶于水
③邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低
④水分子在高温下很稳定
A.①②③B.①②④C.②③D.①④
科目:高中化学 来源: 题型:
【题目】(1)钛镁合金是制造高性能飞机的重要材料。金属钛、镁均采用六方最密堆积,下列说法正确的是_____(填序号)。
A.钛镁合金用于制造高性能飞机主要是由于它们的价格昂贵,制造出的飞机能卖好价钱
B.钛、镁金属晶体中,其配位数均为12
C.金属钛的熔点(1668℃)很高,与金属键无关
(2)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电学性能。下列说法正确的是______(填序号)。
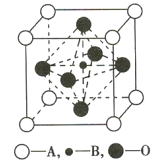
A.金属Ca、Sr、Ba采用体心立方密堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式可表示为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
(3)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有![]() 三种同素异形体,其晶胞结构如图所示。
三种同素异形体,其晶胞结构如图所示。
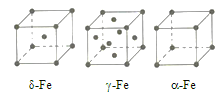
①![]() 晶胞中含有的铁原子数为___________。
晶胞中含有的铁原子数为___________。
②![]() 、
、![]() 两种晶体中铁原子的配位数之比为___________。
两种晶体中铁原子的配位数之比为___________。
③若![]() 晶胞的边长为a cm,
晶胞的边长为a cm, ![]() 晶胞的边长为b cm,则两种晶体的密度之比为___________。
晶胞的边长为b cm,则两种晶体的密度之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是 ( )
A. 该有机物能发生加成反应,但不能发生取代反应
B. 该有机物不能使酸性高锰酸钾溶液和溴水褪色
C. 该有机物分子中的所有原子不可能在同一平面上
D. 该有机物的一溴代物最多有5种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁作阳极,利用电解原理可使废水中的污染物凝聚而分离,其工作原理如图所示。下列说法错误的是( )
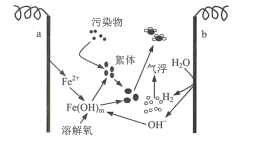
A.电极b为阴极
B.a极的电极反应式:Fe-2e-=Fe2+
C.处理废水时,溶液中可能发生反应:4Fe2++O2+8OH-+2H2O=4Fe(OH)3
D.电路中每转移3 mol电子,生成1 mol Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VA族元素氮、磷、砷(As)、锑(Sb)、铋(Bi)的单质及其化合物在科研和生产中有许多重要用途。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的价电子排布式为_______。
(2)第三周期元素中第一电离能大于磷的元素有_______(填元素符号)。
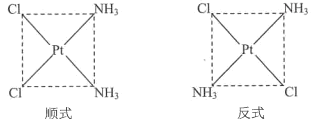
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是_______(填“顺式”或“反式”)。
(4)氨硼烷(BH3NH3)是一种储氢材料,与乙烷互为等电子体,熔点为104℃。氨硼烷晶体中各种微粒间的作用力涉及________(填标号)。
A.范德华力 B.离子键 C.配位键 D.金属键
(5)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,可杀死各种草本植物,其阴离子的立体构型为___。
(6)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H44+,其结构式为_______,其中N原子的杂化方式为________。
(7)镧、铁、锑三种元素组成的一种固体能实现热电效应。该固体晶胞结构如图l所示,晶胞参数为a nm,Fe原子填在6个Sb原子形成的正八面体空隙中,晶胞6个表面的结构都如图2所示。
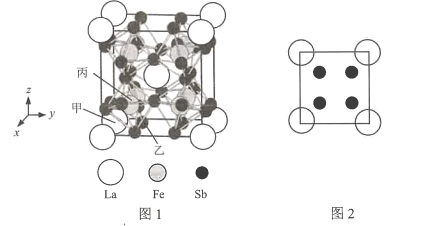
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图l中原子甲的坐标为(0,0,0),原子乙的坐标为(![]() ,
,![]() ,0),则原子丙的坐标为________。
,0),则原子丙的坐标为________。
②设阿伏加德罗常数的值为NA,则该固体的密度ρ=__g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
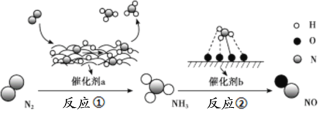
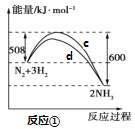
下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的国家标准是:每100g婴幼儿奶粉中含蛋白质![]() 。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取
。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%计算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取![]() 该奶粉样品进行反应后,生成的
该奶粉样品进行反应后,生成的![]() 和
和![]() 质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于________(填“合格”或“不合格”)奶粉。
质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉属于________(填“合格”或“不合格”)奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)![]() 3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
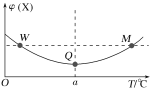
A.M点时,Y的转化率最大
B.平衡后充入X,达到新平衡时X的体积分数减小
C.升高温度,平衡常数减小
D.W、M两点Y的正反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构、熔点/℃角度分析,原因是______________。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________。
GeCl4 | GeBr4 | Gel4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__________,微粒之间存在的作用力是________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C(
);C(![]() ,0,
,0,![]() ),则D原子的坐标参数为_________。
),则D原子的坐标参数为_________。
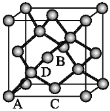
②晶胞参数:描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com