
下列用于解释实验事实的化学方程式正确的是( )
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-= Al(OH)3 
B.纯碱溶液使酚酞变红:CO32-+2H2O ?H2CO3+2OH-
C.乙酸清除水垢后的化学反应原理:2H++CO32-= CO2 + H2O
+ H2O
D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+
D
【解析】
试题分析:A.氨水中的一水合氨是弱碱,应该写化学式。Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3NH3·H2O= Al(OH)3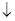 +3NH4+;错误;B.纯碱是强碱弱酸的盐,盐水解是分步进行的,溶液使酚酞变红:CO32-+2H2O ?HCO3-+OH-,错误;C.乙酸是弱酸,应该写化学式,清除水垢后的化学反应原理:2CH3COOH+CO32-= CO2
+3NH4+;错误;B.纯碱是强碱弱酸的盐,盐水解是分步进行的,溶液使酚酞变红:CO32-+2H2O ?HCO3-+OH-,错误;C.乙酸是弱酸,应该写化学式,清除水垢后的化学反应原理:2CH3COOH+CO32-= CO2 + H2O+2CH3COO-,错误;D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+,符合反应事实,离子方程式拆写也符合原则,正确。
+ H2O+2CH3COO-,错误;D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+,符合反应事实,离子方程式拆写也符合原则,正确。
考点:考查离子方程式的正误判断的知识。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:2015届辽宁省分校高三上学期期初考试化学试卷(解析版) 题型:选择题
在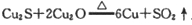 反应中,说法正确的是( )
反应中,说法正确的是( )
A.Cu2O在反应中被氧化 B.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物 D.若反应中转移12mol电子,则生成6molCu
查看答案和解析>>
科目:高中化学 来源:2015届辽宁沈阳市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
如图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3。)图中⑤表示的物质是

A.Al或Fe2O3 B.NaOH溶液
C.氢碘酸 D.NH3或O2
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种非0族元素组成,其原子个数比为14:4:5:1:1.其中A是元素周期表中原子半径最小的元素,C、D元素同主族且原子序数D为C的二倍,E元素的原子外圈电子排布为(n-l)dn+6nsl 。 请回答下列问题:
(1)元素D在周期表中的位置是____________________;
(2)该配位化合物的化学式为____________________;
(3)A元素可分别与B、C、D元素化合形成三种电子数相等的分子,它们分别为________;其中A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为_____________;
(4)EDC4常作电镀液,其中DC42-的空间构型是________.其中D原子的杂化轨道类型是_____________;
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61 10-8cm,则E的密度为______________________.
10-8cm,则E的密度为______________________.

查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:填空题
(10分)工业制氢气的一个重要反应是:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
① C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
② C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③ H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) === CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:

①以下反应能说明CO(g)+H2O(g)  CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
A.容器中CO的含量保持不变 B.容器中CO2浓度与CO浓度相等
C. (CO)=
(CO)= (H2O) D.容器中混合气体的平均相对分子质量保持不变
(H2O) D.容器中混合气体的平均相对分子质量保持不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时 ___________
___________ (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
查看答案和解析>>
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.3.2g由O2和O3组成的混合物中含有氧原子的数目为0.2NA
B.0.1mol苯中含有碳碳双键的数目为0.3 NA
C.标准状况下,11.2L三氯甲烷中含有分子的数目为0.5 NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4 NA
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(20分)
(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
②若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比_______(填“大于”、“小于”或“等于”)10,说明理由_____________________________ 。
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
①H2SO4溶液: HSO4- | ②NaHSO4溶液: HSO4- | ③盐酸 HCl=H++Cl |
10% | 29% | 100% |
25℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序
是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是 (填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是________________ 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.所有自发进行的化学反应都是放热反应 B.自发过程将导致体系的熵增大
C.△H-T△S<0反应能自发进行 D.同一物质的固、液、气三种状态的熵相同
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:填空题
(14分)亚铁氰化钾(K4Fe(CN)6 ,黄血盐)在实验室、电镀、食品添加剂及医学上可用于冶疗铊(Tl)中毒、烧制青花瓷时可用于绘画等有广泛用途。已知HCN是一种极弱的酸。现有一种用含NaCN废水合成黄血盐的主要工艺流程如下:

(1)实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于 溶液,再用蒸馏水稀释,NaCN水解的离子方程式为_________。
(2)实验室K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Tl2SO4中毒,试写出上述检验Fe3+反应的离子方程式为 。
(3)流程图中加入碳酸钠溶液主要目的是 。
(4)相同温度下溶解度:Na4[Fe(CN)6] K4[Fe(CN)6](选填:“>”、“=”、“<”)。
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K4Fe(CN)6=□KCN+□Fe3C+□C+□(CN)2↑+□N2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],写出AgCl与黄血盐制取电镀液的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com