
(15分) 现有A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。已知A与E、D与F分别同主族, E、F、G同周期;A、C的最外层电子数之和与D的最外层电子数相等,A与D形成的化合物常温下为液态,A分别与F、G形成的气体分子电子总数相等、B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具。
请回答下列问题:
(1)元素C在周期表中的位置是_______________
元素E的原子结构示意图为
(2)C的气态氢化物的水化物与其最高价氧化物的水化物可发生反应,离子方程式为:
(3)在一定条件下,A、D的单质和A、D、E形成的离子化合物的水溶液可构成电池,该电池负极的电极反应式为 , 该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(4)化合物C2A4(g) 是一种高效清洁的火箭燃料,0.25 mol C2A4完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,同时放出热量133.5 kJ的热量。则该反应的热化学方程式为(用具体物质化学式表示) 。
(15分)
(1)第二周期VA; 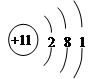 (4分)
(4分)
(2)NH3.H2O+H+=NH4++H2O (3分)
(3)H2+2OH--2e-=2H2O ( 3分) 减小 (2分)
(4)N2H4(g)+O2(g)==N2(g)+2H2O(g) △H ="-534" kJ·mol-1 (3分)
解析试题分析:B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具,则B为C元素;A与D形成的化合物常温下为液态,则A为H元素、D为O元素;根据原子序数依次增大,C为N元素;已知A与E、D与F分别同主族,这七种元素都位于短周期,A分别与F、G形成的气体分子电子总数相等,所以E为Na元素、F为S元素、G为Cl元素。
(1)C为N元素,在周期表中的位置是:第二周期VA族; Na原子根据示意图: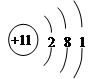
(2)C的气态氢化物的水化物为NH3?H2O,最高价氧化物的水化物为HNO3,发生酸碱中和反应,离子方程式为:NH3.H2O+H+=NH4++H2O
(3)A、D的单质分别为H2、O2,A、D、E形成的离子化合物为NaOH,形成燃料电池,负极发生H2失去电子的反应,电极方程式为:H2+2OH--2e-=2H2O;电池反应为2H2+O2=2H2O,生成了H2O,使NaOH溶液的浓度减小,所以电解质溶液的pH将减小。
(4)化合物C2A4为N2H4,完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,则生成物是N2和H2O,0.25 mol N2H4完全燃烧放出热量为133.5 kJ,则1mol N2H4完全燃烧放出热量为534 kJ,所以热化学方程式为:N2H4(g)+O2(g)==N2(g)+2H2O(g) △H ="-534" kJ·mol-1
考点:本题考查元素的推断、原子结构示意图、物质的性质、原电池原理、热化学方程式的书写。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:单选题
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为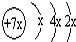 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 ,下列比较中正确的是( )
,下列比较中正确的是( )
| A.原子半径:a>c>d>b | B.最高价氧化物对应水化物的酸性:c>d>a |
| C.原子序数:a>d>b>c | D.单质的氧化性:a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知短周期元素的离子:aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
| A.离子半径 C>D>B>A | B.原子序数 D>C>B>A |
| C.原子半径 A>B>D>C | D.单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中 的含量变化检测核电站是否发生放射性物质泄漏。下列有关
的含量变化检测核电站是否发生放射性物质泄漏。下列有关 的叙述中错误的是( )
的叙述中错误的是( )
A. 的化学性质与 的化学性质与 相同 相同 | B. 的原子序数为53 的原子序数为53 |
C. 的原子核外电子数为78 的原子核外电子数为78 | D. 的原子核内中子数多于质子数 的原子核内中子数多于质子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com