
【题目】香精是由人工合成的模仿水果和天然香料气味的浓缩芳香油,属于人造香料,多用于制造 食品,化妆品和卷烟等.
Ⅰ、苏合香醇是一种食用香精,由 C8H10 合成其路线如图 1 所示.

回答 1-2 题:
Ⅱ、有机物 G 也是一种常见香料,其合成路线如图 2.其中 D 的相对分子质量为 88,它的核磁共振 氢谱显示只有三组峰;F 与苏合香醇互为同系物.

已知:R-CH=CH2 ![]() R-CH2CH2OH
R-CH2CH2OH
回答 3-6 题:
(1)苏合香醇的结构简式为____________,它不能发生的有机反应类型有____________。
①取代反应 ②加成反应 ③消去反应 ④加聚反应 ⑤氧化反应 ⑥水解反应
(2)Y 分子中最多有____________个原子共平面。
(3)C 与新制 Cu(OH)2 悬浊液反应的化学方程式为____________。
(4)G 中含有两个甲基,E 可发生银镜反应,在催化剂存在下,1mol E 与 2mol H2 可以反应生成 F, 则 E 的结构简式为____________。
(5)D 与 F 反应的化学方程式为____________。
(6)苯环上有两个取代基,且显弱酸性的 F 的同分异构体共有____________种。
【答案】 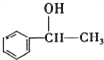 ④、⑥ 16
④、⑥ 16 ![]()
![]()
 6
6
【解析】(1).C8H10为苯的同系物,与氯气在光照条件下取代侧链上的H原子,生成卤代烃,在热的NaOH溶液中发生卤原子的水解反应;苏合香醇被氧化后不能发生银镜反应,说明被氧化后不能生产醛基,即苏合香醇中羟基不在端部,则其结构式为: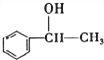 ;
;
能发生①取代反应,含有苯环能发生 ②加成反应,和羟基连接的C原子的相邻C原子上有H,可发生 ③消去反应,不含有碳碳双键,不能发生 ④加聚反应,含有-OH能发生 ⑤氧化反应,不含酯基、肽键、卤原子,不能发生 ⑥水解反应,故选择④、⑥;
(2).X发生消去反应,生成物的结构简式为, 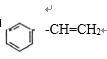 ,苯环为平面正六边形结构,乙烯为平面结构,所以所有原子可能共平面,所以最多有16个原子共平面;
,苯环为平面正六边形结构,乙烯为平面结构,所以所有原子可能共平面,所以最多有16个原子共平面;
(3).F与苏合香醇互为同系物,F为醇,D为羧酸,由D的相对分子质量为 88且仅含有3种环境下的H原子,D为2甲基丙酸。则C 与新制 Cu(OH)2 悬浊液反应为醛氧化为酸的反应,反应条件为NaOH并加热,且生成物Cu2O为砖红色沉淀,方程式为:![]() ;
;
(4).D与F发生酯化反应,则根据D和G的分子式可得,F的分子式为C9H12O,因为G含有两个甲基,所以E中不含甲基且含有醛基,1molE可以与2molH2发生加成反应生成F, 所以E得分子式为C9H8O,其结构式为: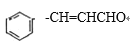 ,, ;
,, ;
(5).F的结构式为E加成2molH2,为 ![]() ,F与D的反应为酯化反应,其方程式为:
,F与D的反应为酯化反应,其方程式为: ;
;
(6).呈弱酸性,说明含有苯羟基,又苯环上仅有2个取代基,则另一个取代基可为:-CH2-CH2-CH3和 ,根据苯环上取代基的邻间对位,F共存在6中同分异构体。
,根据苯环上取代基的邻间对位,F共存在6中同分异构体。


科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.
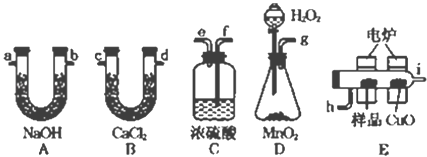
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是g→ → →h→i→ → → → ._______________
(2)燃烧管中CuO的作用是______.
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取3.24g样品,经充分反应后,A管质量增加9.24g,B管质量增加2.16g,则该样品的实验式为______.
(4)要确定该物质的分子式,还要知道该物质的______.经测定其蒸气密度为4.82g/L(已换算为标准状况下),则其分子式为______.
(5)经红外光谱分析知该化合物的分子中存在1个苯环,苯环上只有1个支链,且支链中有1个甲基.试写出该有机物的结构简式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A. 有CO、CO2、O3三种气体,它们各含有1 mol O,则三种气体物质的量之比为3:2:1
B. n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为35.5m/n
C. 常温下,a L氧气和氮气的混合物含有的分子数就是(a/22.4)×6.02×1023个
D. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积等pH的盐酸和氯化铵两溶液,下列说法正确的是
A. 两溶液导电能力相同
B. 分别与适量且等量的锌反应,平均反应速率后者大
C. 分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积相同
D. 稀释10倍后,盐酸的pH比氯化铵溶液的pH小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成A12O3 , 将Al片改成Al粉
B.Fe与稀硫酸反应制取H2时,该用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Na与水反应时增大水的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2分别是1s电子的概率分布图和原子轨道图。下列有关认识正确的是

A. 图1中的每个小黑点表示1个电子
B. 图1中的小黑点表示某一时刻,电子在核外所处的位置
C. 图2表示1s电子只能在球体内出现
D. 图2表明1s轨道呈球形,有无数对称轴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释. 100 倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________ mol·L1(计算结果保留 2位有效数字)。
(2)某同学取 100mL 该“84消毒液” ,稀释后用于消毒,稀释后的溶液中n(Na+)=_______ mol.
(3)“84消毒液”与稀硫酸混合用可增强消毒能力,某消毒小组用98%(ρ=1.84g·cm-3)的浓硫酸配制2L 2.3mol·L-1的稀硫酸,用于增强“84消毒液”的消毒能力,需用浓硫酸的体积为_______mL。
(4)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。实验室用密度为1.25 g·mL-1,质量分数36.5%的浓盐酸配制0.1 mol·L-1的盐酸240 mL。
①配制240 mL 0.1 mol·L-1的盐酸应选用______mL的容量瓶。
②下列操作对所配溶液的浓度有何影响 (填“偏大”、“偏小”或“无影响”)。
A.定容时,俯视刻度线,浓度 ____________ ;
B.用量筒量取浓盐酸时,仰视刻度线,浓度 __________ ;
C.定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度 ____________ 。
D.容量瓶在使用前未干燥,里面有少量蒸馏水, 浓度 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂周围的空气含有较多二氧化硫,某化学兴趣小组设计了以下装置和方法测定空气(内含N2、O2、SO2、CO2等)中SO2含量。
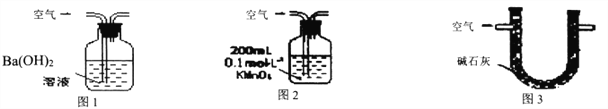
甲.用图1所示装置,通入V升空气,测定生成沉淀的质量
乙.用图2所示装置,当KMnO4溶液刚好褪色时,测定通入空气的体积V
丙.用图3所示装置,通入V升空气,测定U型管增加的质量
(1)你认为可行的操作是________。(填“甲、乙、丙”)
(2)某环保部门为了测定空气中SO2含量,做了如下实验:取标准状况下的空气VL,缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①若通入气体的速率过快,则测定的SO2的体积分数_______。(选填“偏高”、“偏低”或“不受影响”)。
②如何判断氯化钡溶液已经加过量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于镍粉的制造,其中一种生产工艺如下(已知还原性:Fe2+>Ni2+):
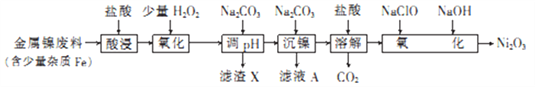
回答下列问题:
(1) Ni2O3中Ni 的化合价为________________。
(2)为了提高金属镍废料浸出速率,在“酸浸”时可采取的措施有_______________________(写两条)。
(3)若将H2O2溶液改为酸性KMnO4溶液(在该实验条件下,Ni2+不能被KMnO4氧化),则“氧化”过程中的离子方程式为_______________________;加入Na2CO3溶液调pH,产生的“滤渣X”是_____________。
(4)从滤液A中可回收利用的主要物质是___________________;加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为_________________________。
(5)工业上用镍为阳极,电解0.05~0.1mol·L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl 的浓度对阴极电流效率及镍的成粉率的影响如下图所示:
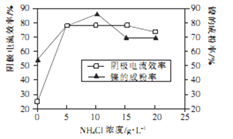
①NH4Cl浓度最好控制为____________g·L-1。
②当NH4Cl浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,相应的电极反应式
为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com