
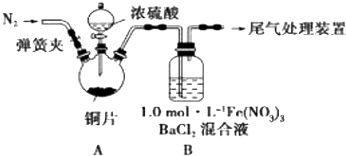
分析 (1)测定SO2的量必须做到不能在测量时损耗,便于测定分析,碱石灰能吸收二氧化硫和水,二氧化硫易溶于水;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)①根据猜想1:SO2与Fe3+反应,Fe3+具有氧化性,二氧化硫具有还原性发生反应生成三价铁和硫酸根,据此书写方程式;高锰酸钾具有强氧化性,二氧化硫具有还原性,两者能发生氧化还原反应;
②根据猜想2:在酸性条件下SO2与NO3-反应,可将B中的Fe(NO3)3溶液中的三价铁离子换掉,硝酸根不变即可;
③尾气主要是二氧化硫以及氮的氧化物气体,可以用碱来吸收.
解答 解:(1)A.将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收二氧化硫和水蒸气,称量后计算不准确,故A错误;
B.将产生的气体缓缓通入足量Na2S溶液后,二氧化硫中+4价的硫和硫化钠中-2价硫发生价态归中反应生成零价的硫单质,可通过测量所得沉淀的质量进行二氧化硫的气体体积测定,故B正确;
C.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故C正确;
故答案为:A;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)①按猜想1:SO2与Fe3+反应,Fe3+具有氧化性,二氧化硫具有还原性发生反应生成三价铁和硫酸根,离子方程式是Ba2++SO2+2Fe3++2H2O═BaSO4↓+4H++2Fe2+;( 可分步写SO2+2Fe3++2H2O═SO42-+4H++2Fe2+,Ba2++SO42-═BaSO4↓),证明该猜想1中生成的还原产物,某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去,该同学做法错误,因高锰酸钾具有强氧化性,二氧化硫具有还原性,所以两者发生氧化还原反应,SO2也可以使酸性高锰酸钾褪色,
故答案为:Ba2++SO2+2Fe3++2H2O═BaSO4↓+4H++2Fe2+( 可分步写SO2+2Fe3++2H2O=SO42-+4H++2Fe2+,Ba2++SO42-=BaSO4↓);不正确;SO2也可以使酸性高锰酸钾褪色;
②按猜想2,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可将B中的Fe(NO3)3溶液中的三价铁离子换掉,硝酸根不变,所以可用6.0mol•L-1NaNO3和0.2mol•L-1盐酸等体积混合的溶液代替,故答案为:c;
③尾气主要是二氧化硫以及氮的氧化物气体,可以用NaOH溶液来吸收,故答案为:用NaOH溶液来吸收.
点评 本题考查浓硫酸的性质实验探究,题目难度中等,注意把握二氧化硫的性质为解答该题的关键,注意二氧化硫的还原性为重要知识点.


科目:高中化学 来源: 题型:多选题
| A. | 氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH4+]:[SO42-] | |
| B. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中,[H+]之比 | |
| C. | Na2CO3溶液中,[Na+]:[CO32-] | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加H2O(g) 的量 | |
| B. | 增加C(s)的量 | |
| C. | 将容器的体积缩小一半 | |
| D. | 保持压强不变,充入N2,使容器的体积变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁制容器盛放硫酸铜溶液,容器易被腐蚀 | |
| B. | 利用催化措施,可以将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 防止酸雨发生的重要措施之一是使用清洁能源 | |
| D. | 氧化铜呈红色,可作为制造陶瓷的红色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com