
【题目】下列实验设计能完成或实验结论合理的是
A. NH4Cl固体中混有少量的I2,可用加热的方法将I2除去
B. 少量浓硝酸保存在无色细口瓶中
C. 用浓硫酸吸收二氧化硫中混有少量SO3气体
D. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
科目:高中化学 来源: 题型:
【题目】Ⅰ.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下列资料表示了三种金属被人类开发利用的大致年限。
![]()
(1)上述资料中的三种常用金属的开发利用之所以有先后,主要取决于________。
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
(2)早在西汉成书的《淮南万毕术》里,就有“曾青得铁则化为铜”的记载。曾青又有空青、白青、石胆、胆矾等名称,其实都是天然的硫酸铜。
①写出“曾青得铁则化为铜”的化学方程式_________________________________________________。
②若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式。

正极反应: _______________________________________;
负极反应: _______________________________________。
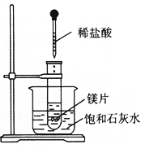
Ⅱ.在一只试管中放入几小块镁片,把试管放入盛有25 ℃的饱和石灰水
的烧杯中,用胶头滴管滴5 mL盐酸于试管中。试回答下列问题:
(1)实验中产生的现象是:____________________________________________________________。
(2)写出有关的化学方程式:____________________________________________________________。
(3)由实验推知:MgCl2溶液与H2的总能量________(填“<”“>”或“=”) Mg片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中表示的能量装化关系错误的是( )
A.植物光合作用:光能→生物质能
B.原电池:电能→化学能
C.木柴烧饭:生物质能→热能
D.太阳能热水器:光能→热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A. 液溴和苯分别受热变为气体
B. 干冰和氯化铵分别受热变为气体
C. 二氧化硅和铁分别受热熔化
D. 食盐和葡萄糖分别溶解在水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是
A.MgO固体(Al2O3) B.Na2CO3固体(NaHCO3)
C.FeCl2溶液(CuCl2) D.Fe2O3固体(SiO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
A. 提出了原子学说 B. 提出了元素周期律
C. 提出了分子学说 D. 制定了科学的元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比8:1:2,则溶液中Na2SO4、NaCl、NaOH个数比为( )
A. 1:1:1 B. 1:4:2 C. 1:2:4 D. 1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。

查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的作用是 。
(3)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是 。
(4)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式 ;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是 。
(5)制得的粗产品中含有Fe(OH)3、KCl等杂质。提纯方案:将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式) 、 ,过滤时不用普通漏斗而采用砂芯漏斗的原因是 。
②晶体用乙醇洗涤的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com