
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是
A.MgO固体(Al2O3) B.Na2CO3固体(NaHCO3)
C.FeCl2溶液(CuCl2) D.Fe2O3固体(SiO2)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如下:
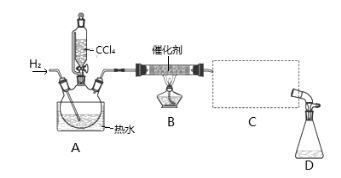
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 水中溶解性 |
CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
CCl4 | 154 | 1.59 | 76.7 | 难溶 |
实验步骤:
①检验装置气密性;②开始通入H2; ③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水; ⑤向三颈瓶中滴入20 mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15 g。请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为 。
(2)B处中发生主要反应的化学方程式为 。
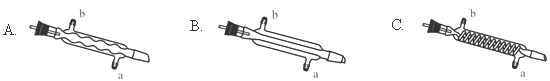
(3)C处中应选用的冷凝管为 (填选项字母);冷水应从该冷凝管的 (填“a”或“b”)口接入。
(4)步骤⑥中,用水洗涤的目的为 。
(5)该实验中,氯仿的产率为 。
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③____________________。
(2)设同一条件下的体积比为:V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________________________。
(3)D装置的石棉中均匀混有KI粉末,其作用是________________________________。
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式________________________________________。
(5)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛。
(1)已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)△H=-78kJmol-1
HOCH2CH2OH(g)△H=-78kJmol-1
2H2(g)+O2(g)![]() 2H2O(l)△H=-571.6kJmol-1
2H2O(l)△H=-571.6kJmol-1
H2O(g)=H2O(l)△H=-44kJmol-1
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
(2)上述制乙二醛反应的化学平衡常数表达式K=________;当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间时,乙二醛产率降低的主要原因是________;当温度超过495℃时,乙二醛产率降低的主要原因是________;

(3)产品中乙二醛含量测定的实验过程如下:
准确量取25.00mL乙二醛样品置于锥形瓶中,加入盐酸羟胺(NH2OH·HCl)溶液,使乙二醛充分反应,用0.1000mol/L的NaOH溶液滴定生成的盐酸至终点(为了避免滴定剂与溶液中过量的NH2OH·HCl反应,选择溴酚蓝作指示剂),消耗NaOH溶液12.50mL,计算样品中乙二醛的含量(g/L)。(写出计算过程)
(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能完成或实验结论合理的是
A. NH4Cl固体中混有少量的I2,可用加热的方法将I2除去
B. 少量浓硝酸保存在无色细口瓶中
C. 用浓硫酸吸收二氧化硫中混有少量SO3气体
D. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的六种元素。已知:A是周期表中原子半径最小的元素.B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子。
回答下列问题:
(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示)
(2)F在周期表中位于 区,与F同周期且未成对电子数最多的元素为 (填写元素符号),该元素价电子排布图为 ;
(3)B、E两种元素可形成BE3型化合物其化学式为 ,中心原子杂化方式为 ,分子的空间构型为 ;
(4)化合物BA3易溶解于化合物A2C中,其原因是 ;
(5)化合物DC熔点高于DE2的熔点,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O, 含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1) “酸浸”时盐酸与 CuCO3·Cu(OH)2 反应的化学方程式为 ________________。 为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③______________。
(2) “氧化”时发生反应的离子方程式为__________________。
(3) “滤渣 2”的主要成分为_______(填化学式);“调pH”时,pH 不能过高,其原因是___________。
(4) “加热脱水”时, 加入 SOCl2的目的是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com