
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛。
(1)已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)△H=-78kJmol-1
HOCH2CH2OH(g)△H=-78kJmol-1
2H2(g)+O2(g)![]() 2H2O(l)△H=-571.6kJmol-1
2H2O(l)△H=-571.6kJmol-1
H2O(g)=H2O(l)△H=-44kJmol-1
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
(2)上述制乙二醛反应的化学平衡常数表达式K=________;当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间时,乙二醛产率降低的主要原因是________;当温度超过495℃时,乙二醛产率降低的主要原因是________;

(3)产品中乙二醛含量测定的实验过程如下:
准确量取25.00mL乙二醛样品置于锥形瓶中,加入盐酸羟胺(NH2OH·HCl)溶液,使乙二醛充分反应,用0.1000mol/L的NaOH溶液滴定生成的盐酸至终点(为了避免滴定剂与溶液中过量的NH2OH·HCl反应,选择溴酚蓝作指示剂),消耗NaOH溶液12.50mL,计算样品中乙二醛的含量(g/L)。(写出计算过程)
(已知:![]() )
)
【答案】(1) (2) K=![]() 升高温度,主反应平衡逆向移动 温度超过495℃时,乙二醇大量转化为二氧化碳等副产物 (3)2.9g/L
升高温度,主反应平衡逆向移动 温度超过495℃时,乙二醇大量转化为二氧化碳等副产物 (3)2.9g/L
【解析】
试题分析:(1)已知:Ⅰ.OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)△H=-78kJmol-1
HOCH2CH2OH(g)△H=-78kJmol-1
Ⅱ.2H2(g)+O2(g)![]() 2H2O(l)△H=-571.6kJmol-1
2H2O(l)△H=-571.6kJmol-1
Ⅲ.H2O(g)=H2O(l)△H=-44kJmol-1
根据盖斯定律,Ⅱ-Ⅰ-Ⅲ×2可得:HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g),则△H=-571.6kJmol-1-(-78kJmol-1)-(-44kJmol-1)×2=-405.6kJmol-1;
OHC-CHO(g)+2H2O(g),则△H=-571.6kJmol-1-(-78kJmol-1)-(-44kJmol-1)×2=-405.6kJmol-1;
(2)反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的化学平衡常数表达式K=
OHC-CHO(g)+2H2O(g)的化学平衡常数表达式K=![]() ;主反应HOCH2CH2OH(g)+O2(g)
;主反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低;
OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低;
(3)根据关系式OHCCHO~2HCl~2NaOH;滴定消耗NaOH的物质的量为0.1000mol/L×0.012.50L=1.25×10-3mol,乙二醛的质量为58g/mol×1.25×10-3mol=![]() ,样品中乙二醛的含量=
,样品中乙二醛的含量=![]() g/L=2.9g/L。
g/L=2.9g/L。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的化合物,且这几种化合物中每种都由2种元素组成。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一种一元强酸,s通常为难溶于水的混合物。上述物质的转化关系如图所示。

(1)四种元素的元素符号为:W_______、X_________、Y________、Z________
(2)q的结构式为______
(3)X、Z的非金属性较强的是_____(填元素符号),写出能证明该事实的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 稀硫酸 | CaCO3[ | CO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
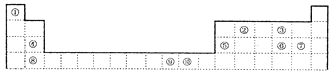
请回答下列问题:
(1)表中②和⑦两元素形成的五原子分子的结构式为_______________________;
(2)由③和⑤两元素形成的物质与NaOH溶液反应的离子方程式为_______________________;
(3)由元素①和②的原子构成的R离子空间构型为平面正三角形,则该离子符号为________;其中心原子的杂化类型为_______________________;
(4)下列说法正确的是_______________________;
a.电负性②>③ b.③⑥两元素能形成极性分子
c.④⑦两元素形成的化合物中只含离子键 d.⑧⑨⑩三元素最外层电子数均为2
(5)M元素与表中元素⑨既同族又同周期,是一种重要的金属元素,若人体内M元素的含量偏低,则会影响O2在体内的正常运输。已知M2+与CN-溶液反应得到M(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成六配位化合物。
上述沉淀溶解过程的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是
A.MgO固体(Al2O3) B.Na2CO3固体(NaHCO3)
C.FeCl2溶液(CuCl2) D.Fe2O3固体(SiO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等。按要求回答下列问题:


(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明X非金属性强于Z: _______________(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是__________ (用离子方程式表示)
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________;
(5)已知:①C(s)+ O2(g)= CO2(g)![]() H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"
H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"![]() H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)![]() H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
(6)已知:CO(g)+H2O(g)![]() H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的![]() H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
![]()
(1)写出元素符号:A ;B ;C 。
(2)C的原子结构示意图: ;B的最高价氧化物对应水化物的化学式为 。
(3)A的氢化物的水溶液显 (填“酸”或“碱”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。

(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
(3)为安全起见,工业生产中需对空气中的CO进行检测。
①粉红色的PdCl2溶液可以检测空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应中转移的电子数为 。
②使用电化学CO气体传感器定量检测空气中CO含量,其模型如图所示。这种传感器利用了原电池原理,则该电池的负极反应式为 。

(4)CO与Fe在一定条件下可形成五羰基铁[Fe(CO)5],该化合物易吸收H2生成氢化羰基铁。氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠。五羰基铁吸收H2的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com