
����Ŀ���±�Ϊ��ʽ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء�
��ش��������⣺
��1��������������Ԫ���γɵ���ԭ�ӷ��ӵĽṹʽΪ_______________________��
��2������������Ԫ���γɵ�������NaOH��Һ��Ӧ�����ӷ���ʽΪ_______________________��
��3����Ԫ����������ԭ�ӹ��ɵ�R���ӿռ乹��Ϊƽ���������Σ�������ӷ���Ϊ________��������ԭ�ӵ��ӻ�����Ϊ_______________________��
��4������˵����ȷ����_______________________��
a���縺�������� b���ۢ���Ԫ�����γɼ��Է���
c���ܢ���Ԫ���γɵĻ�������ֻ�����Ӽ� d��������Ԫ��������������Ϊ2
��5��MԪ�������Ԫ������ͬ����ͬ���ڣ���һ����Ҫ�Ľ���Ԫ�أ���������MԪ�صĺ���ƫ�ͣ����Ӱ��O2�����ڵ��������䡣��֪M2+��CN-��Һ��Ӧ�õ�M(CN)2���������������KCN��Һʱ�����ܽ⣬��������λ�����
���������ܽ���̵Ļ�ѧ����ʽΪ_______________________��
���𰸡���1��![]() ��2��Al2O3+2OH-=2AlO2-+H2O ��3��CH3+ sp2 ��4��bc
��2��Al2O3+2OH-=2AlO2-+H2O ��3��CH3+ sp2 ��4��bc
��5��Fe(CN)2+4KCN=K4[Fe(CN)6]
��������
�����������Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪC����ΪO����ΪMg����ΪAl����ΪS����ΪCl����ΪCa����ΪNi����ΪCu��
��1��������������Ԫ���γɵ���ԭ�ӷ���ΪCCl4����ṹʽΪ![]() ��
��
��2������������Ԫ���γɵ�Al2O3��NaOH��Һ��Ӧ�����ӷ���ʽΪAl2O3+2OH-=2AlO2-+H2O��
��3����Ԫ��C��H��ԭ�ӹ��ɵ�CH3+���ӿռ乹��Ϊƽ���������Σ�������ԭ�ӵ��ӻ�����Ϊsp2��
��4��a�����ķǽ�����̼ǿ�����縺������������a����b��S��O���γ�SO2��SO3�����������SO2�����η����м��ԣ�SO3ƽ��ṹ��Sλ��O���ɵ������������ģ����ԣ���b��ȷ��c��Mg��Cl��Ԫ���γɵĻ�����MgCl2ֻ�����Ӽ�����c��ȷ��d��Ca��Ni��Cu��Ԫ����Ni����������Ϊ1��������Ԫ������������Ϊ2����d����Ϊbc��
��5��MԪ��Ӧ�ù㷺����һ����Ҫ���������Ԫ�أ���������MԪ�صĺ���ƫ�ͣ����Ӱ��O2�����ڵ��������䣬MΪ��Ԫ�أ�Fe(CN)2�ܽ��ڹ�����KCN��Һ�����ɻ�Ѫ�εĻ�ѧʽΪK4[Fe(CN)6]����Ӧ�Ļ�ѧ����ʽΪFe(CN)2+4KCN=K4[Fe(CN)6]��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ����������� ��
A�����ȷ�Ӧ�����ڷ�Ӧ��������������������������
B�����ȷ�Ӧ�ġ�H��0
C����Ҫ���Ȳ��ܷ�����Ӧ��һ�������ȷ�Ӧ
D������кͷ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķе��ɸߵ������е���
��CH3��CH2��2CH3
��CH3��CH2��3CH3
����CH3��3CH
����CH3��2CHCH2CH3��
A. �ܢڢ٢�
B. �ڢܢ٢�
C. �ܢ٢ڢ�
D. �ڢܢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��ˮ��Դ���ۺ�����ʮ����Ҫ������Ҫͨ����ѧ�仯���ܹ��Ӻ�ˮ�л�õ��������� ��
A��ʳ�Ρ���ˮ B���ơ�þ C���ռ���� D���塢��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�������õIJ��ֹ�����ͼ��ʾ������˵������ȷ������ ��
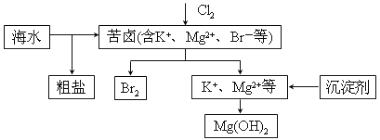
A�����±��ͨ��Cl2��Ϊ����ȡ��
B�����οɲ��ó��Ӻ��ؽᾧ�ȹ����ᴿ
C����ҵ������ѡ��NaOH��Ϊ������
D��������һ�����ÿ�����ˮ�������������壬����SO2���仹ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ�ȩ(OHC-CHO)��һ����Ҫ�ľ�ϸ������Ʒ����ҵ���Ҷ���(HOCH2CH2OH)�����������Ҷ�ȩ��
��1����֪��OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)��H=-78kJmol-1
HOCH2CH2OH(g)��H=-78kJmol-1
2H2(g)+O2(g)![]() 2H2O(l)��H=-571.6kJmol-1
2H2O(l)��H=-571.6kJmol-1
H2O(g)=H2O(l)��H=-44kJmol-1
���Ҷ�������������ӦHOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)�� ��H=__________kJmol-1 ��
OHC-CHO(g)+2H2O(g)�� ��H=__________kJmol-1 ��
��2���������Ҷ�ȩ��Ӧ�Ļ�ѧƽ�ⳣ������ʽK=________����ԭ������������Ϊ1.35ʱ���Ҷ�ȩ������CO2�IJ����뷴Ӧ�¶ȵĹ�ϵ����ͼ��ʾ����Ӧ�¶���450��495��֮��ʱ���Ҷ�ȩ���ʽ��͵���Ҫԭ����________�����¶ȳ���495��ʱ���Ҷ�ȩ���ʽ��͵���Ҫԭ����________��

��3����Ʒ���Ҷ�ȩ�����ⶨ��ʵ��������£�
ȷ��ȡ25.00mL�Ҷ�ȩ��Ʒ������ƿ�У����������ǰ�(NH2OH��HCl)��Һ��ʹ�Ҷ�ȩ��ַ�Ӧ����0.1000mol/L��NaOH��Һ�ζ����ɵ��������յ�(Ϊ�˱���ζ�������Һ�й�����NH2OH��HCl��Ӧ��ѡ���������ָʾ��)������NaOH��Һ12.50mL��������Ʒ���Ҷ�ȩ�ĺ���(g/L)��(д���������)
(��֪��![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ��ֵ�һ����Ȼ��ʮ������������Al��Cu��Fe���ֽ���Ԫ����ɡ��ش��������⣺
��1������һ����ƽ�����������ϸ�����λ����Ķ��ؾ��壬��ͨ��________�������־��塢����ͷǾ��塣
��2�� ��Ԫ��λ��Ԫ�����ڱ��еĵ� �壬��ˮ��Һ�г���Fe2+��Fe3+����ʽ���ڣ����� ���ȶ�����̬Feԭ����________��δ�ɶԵ��ӡ�
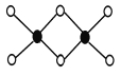
��3����ҵ��ұ���������Ȼ�������Ϊ�Ȼ�������������˫����Al2Cl6�ṹ��ͼ��ʾ��1mol�÷����к� ����λ�����÷��� ����ǡ���ƽ���ͷ��ӡ�
��4�� Fe��CO��5 ��һ����λ����������ʳ����³�Һ̬���۵�Ϊһ20��5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��жϣ��û�����ľ����д��ڵ��������У� ��
A�����Ӽ� B�����Լ� C���Ǽ��Լ� D�����»��� E����� F����λ��
��5���ܶ�����ζ����Է�����ɫ��Ӧ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��21�������ѵ����͡������������Ѱ�(TiO2)����������(Ti)��һ�ֹ������̣�
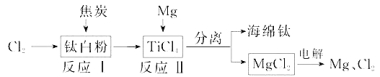
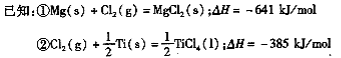
��1���Ѱ�������TiO2+����ˮ����������(H2TiO3)�����������ճ����Ƶõġ�TiO2+����ˮ������ӷ���ʽΪ ��
��2����ӦI��800~900���½��У�������һ�ֿ�ȼ����ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��3����Ӧ�����Ȼ�ѧ����ʽΪ ��
��4���ù��������У�����ѭ��ʹ�õ������� ��
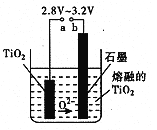
��5����800 ~1000��ʱ���TiO2Ҳ���Ƶú����ѣ�װ������ͼ��ʾ��ͼ��b�ǵ�Դ�� ���������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ΪN��R2����������ΪA��������ӵĺ��������Ϊ�� ��
A. A��N��2 B. A��N+2 C. A+N��2 D. A+N+2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com