
【题目】下列元素中原子半径最大的是( )
A. F B. O C. Mg D. Al
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】Y、Z三种金属,X、Y组成原电池,X是负极;把Z放入X的硝酸盐溶液中,Z表面有X析 出.三者的金属活动性顺序是( )
A.X>Y>Z B.Z>X>Y C.X>Z>Y D.Y>X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是含碳、氢、氧三种元素的单官能团有机物。A水解得B和C,B可以氧化得到C或D,D氧化得到C。若M(X)表示X的摩尔质量,则下式中正确的是
A.M(A)=M(B)+M(C) B.2M(D)=M(B)+M(C)
C.M(B)< M(D)<M(C) D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数之和与D和F原子最外层电子数之和相等;D和E是相邻两种元素。回答下列问题:
(1)E元素的名称: ;其在元素周期表中的位置是 。
(2)AB2的结构式 ;B的氢化物中原子个数比1:1化合物的电子式 。
(3)A和E元素的最高价含氧酸的酸性较强的是 ;(填化学式)
(4)B、C、D、F四种元素原子半径由大到小的顺序是 (填元素符号),离子半径最小的是 (填离子符号)。
(5)A、B、C三种元素组成原子个数比为nA:nB:nC=1:3:2的化合物,将足量AB2通入该化合物溶液中反应的离子方程式是 。
(6)短周期元素M与D元素位于不同主族,根据对角线规则二者某些性质相似。将M的最高价氧化物溶于C的最高价氧化物对应的水化物溶液中,发生反应的离子方程式为 。
(7)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示法错误的是( )
A.吸热反应是由于反应物的总能量比生成物的总能量低
B.放热反应的△H>0
C.需要加热才能发生反应不一定是吸热反应
D.酸碱中和反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如下:
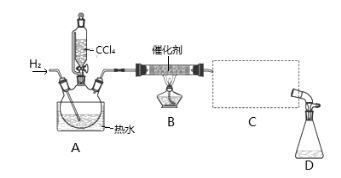
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 水中溶解性 |
CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
CCl4 | 154 | 1.59 | 76.7 | 难溶 |
实验步骤:
①检验装置气密性;②开始通入H2; ③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水; ⑤向三颈瓶中滴入20 mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15 g。请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为 。
(2)B处中发生主要反应的化学方程式为 。
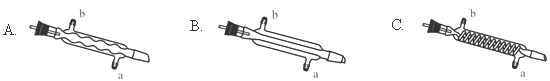
(3)C处中应选用的冷凝管为 (填选项字母);冷水应从该冷凝管的 (填“a”或“b”)口接入。
(4)步骤⑥中,用水洗涤的目的为 。
(5)该实验中,氯仿的产率为 。
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中所列字母分别代表一种元素。

(1)G的气态氢化物比J的气态氢化物 (填“稳定”或“不稳定”,此空1分)。
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(3)元素C和H的最高价氧化物对应的水化物相互反应的离子方程式为: 。
(4)元素G和L的原子序数相差: ,它们的氢化物的水溶液酸性相对强的是: (填化学式)
(5)表中A和F两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为:
A.MnO2B.Na2SO4C.FeCl3D.KMnO4
(6)K为生产、生活中应用最广泛的金属,通常采用的冶炼方法为:
A.电解法 B.热分解法 C.热还原法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。工业用乙二醇(HOCH2CH2OH)氧化法生产乙二醛。
(1)已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)△H=-78kJmol-1
HOCH2CH2OH(g)△H=-78kJmol-1
2H2(g)+O2(g)![]() 2H2O(l)△H=-571.6kJmol-1
2H2O(l)△H=-571.6kJmol-1
H2O(g)=H2O(l)△H=-44kJmol-1
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
OHC-CHO(g)+2H2O(g)的 △H=__________kJmol-1 ;
(2)上述制乙二醛反应的化学平衡常数表达式K=________;当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间时,乙二醛产率降低的主要原因是________;当温度超过495℃时,乙二醛产率降低的主要原因是________;

(3)产品中乙二醛含量测定的实验过程如下:
准确量取25.00mL乙二醛样品置于锥形瓶中,加入盐酸羟胺(NH2OH·HCl)溶液,使乙二醛充分反应,用0.1000mol/L的NaOH溶液滴定生成的盐酸至终点(为了避免滴定剂与溶液中过量的NH2OH·HCl反应,选择溴酚蓝作指示剂),消耗NaOH溶液12.50mL,计算样品中乙二醛的含量(g/L)。(写出计算过程)
(已知:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com