
【题目】在一定温度下,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
【答案】(1) B (2) 0.12 (3) 0.48 (4)60% (5)36.4%
【解析】
试题分析:(1)①氨的生成速率与氨的分解速率相等能说明反应达到平衡状态,正确;②断开1个N≡N键的同时有6个N—H键生成均说明是正反应速率,无法判断是平衡状态,错误;③N2、H2、NH3的体积分数不再变化能说明反应达到平衡状态,正确;④反应物与生成物系数和不等,气体的总压强不变能说明反应达到平衡状态,正确;⑤N2、H2、NH3分子数之比为1:3:2,无法判断是平衡状态,错误;⑥N2、H2和NH3的浓度相等,无法判断是平衡状态,错误;⑦反应进行过程中,v(N2)=1/3v(H2)任何时候均成立,无法判断是平衡状态,错误;⑧v正(N2)=1/3v逆(H2),能说明反应达到平衡状态,正确;⑨质量和体积始终不变,混合物的密度不变,无法判断是平衡状态,错误;⑩反应物与生成物系数和不等,质量始终不变,混合物的平均相对分子质量不变,能判断反应达到平衡,故正确;①③④⑧⑩正确,故选B。
N2(g)+3H2(g) ![]() 2NH3(g),
2NH3(g),
起始物质的量(mol) 3.0 6.0 0
变化物质的量(mol) n 3n 2n
平衡物质的量(mol) 3.0-n 6.0-3n 2n
则:6.0-3n=2n,解得n=1.2;
(2)从反应开始到达到平衡用N2表示该反应的速率为![]() =0.12mol·L-1·min-1;
=0.12mol·L-1·min-1;
(3)平衡时H2的物质的量浓度为![]() mol·L-1= 0.48mol·L-1;
mol·L-1= 0.48mol·L-1;
(4)H2的转化率是![]() ×100%=60%;
×100%=60%;
(5)平衡时混合气体中NH3的体积分数是![]() =36.4%。
=36.4%。


科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ是常见的气体制备,净化,收集装置,根据要求回答下列问题:
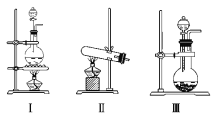
(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置_______,用化学方程式表示制取氯气的反应原理是______________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用发生装置__________,试完成并配平下列离子方程式:_____MnO4- + ____Cl- + ____H+ === ____Mn2+ + ____Cl2↑ + ____。
(3)若选用MnO2与浓盐酸反应制取的氯气含有杂质气体。可以选择 装置来除杂,装置中盛放的溶液依次为 和 。
(4)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是_______________________。
(5)若选用Ⅴ为氯气收集装置,则氯气应从__________口通入。用化学方法检验氯气收集满了的方法是_____________________
(6)氯气有毒,可选择通过 溶液来处理尾气。发生的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列行为不符合这个要求的是( )
A.将煤转化成气体燃料可以有效地减少“温室效应”的气体产生
B.加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用
C.研制开发以水代替有机溶剂的化工涂料
D.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
探究浓度对醋酸电离程度的影响
用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)写出醋酸的电离方程式:___________________________________________。
(2)醋酸溶液中存在的微粒有________________________________________。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是________________________________________________________________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将(填“增大”、“减小”或“不变”)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )
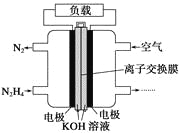
A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为N2H4+4OH--4e-===N2↑+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的化合物,且这几种化合物中每种都由2种元素组成。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r为一种一元强酸,s通常为难溶于水的混合物。上述物质的转化关系如图所示。

(1)四种元素的元素符号为:W_______、X_________、Y________、Z________
(2)q的结构式为______
(3)X、Z的非金属性较强的是_____(填元素符号),写出能证明该事实的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等。按要求回答下列问题:


(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明X非金属性强于Z: _______________(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是__________ (用离子方程式表示)
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________;
(5)已知:①C(s)+ O2(g)= CO2(g)![]() H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"
H="a" kJ· mol-1;②CO2(g) +C(s)="2CO(g)"![]() H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H="b" kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)![]() H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
H="c" kJ· mol-1。工业上生产粗硅的热化学方程式_______________________________;
(6)已知:CO(g)+H2O(g)![]() H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右上表为该反应在不同温度时的平衡常数。则:该反应的![]() H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
H____ 0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com